
近期,北京市药品监督管理局于 8 月 13 日上午举行了北京市药品监管半年工作会议,由党组书记孙力光主持。会议宣告了一则重大消息:2024 年 5 月 30 日,北京市颁发了全国首张干细胞《药品生产许可证》,归属铂生卓越生物科技 (北京) 有限公司,许可证编号为京 20240083,有效期至 2029 年 5 月 29 日,生产地在北京市北京经济技术开发区瑞合西二路 8 号院 7 号楼,生产范围是用于注册申报的治疗用生物制品(人脐带间充质干细胞注射液)。

这一首创之举堪称干细胞治疗领域的重要里程碑,有力地促进了相关产业的发展,为医学进步开拓了新方向,带来诸多机遇与变革。同时,体现出北京市在药品监管创新及对前沿医疗技术支持上的积极尝试,为全国树立了典范,推动其在药品监管与新兴医疗产业协同发展上取得关键进展。
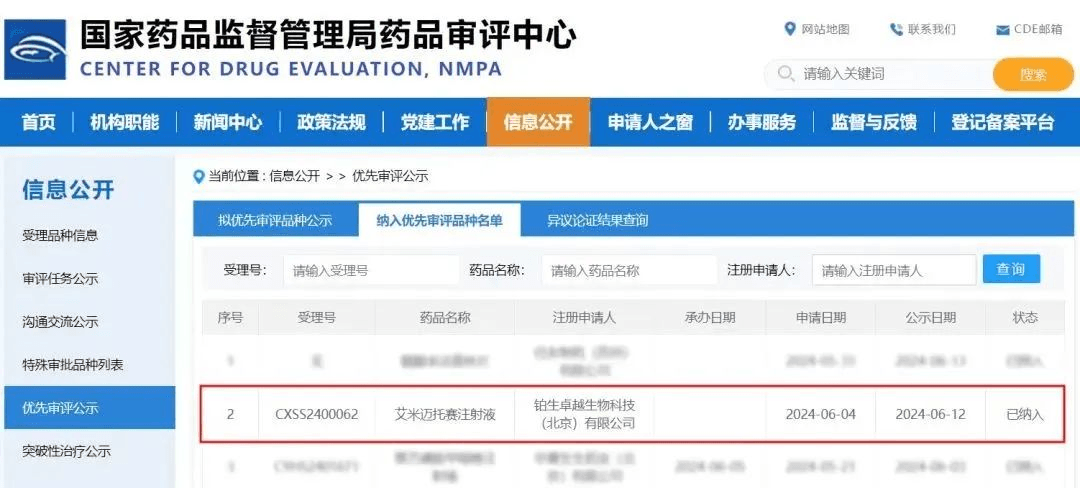
与此同时,中国干细胞研究领域不断前行。2024 年 6 月 27 日,据国家药品监督管理局(NMPA)药品审评中心(CDE)信息,铂生卓越的 “艾米迈托赛注射液”(人脐带间充质干细胞)成为国内首款被 NMPA 受理新药上市申请(NDA)且纳入优先审评的干细胞新药(受理号:CXSS2400062),有望成为国内首款干细胞新药。其审评时限从常规 200 日缩至 130 日,加快了进程。目前,该药物专业审评已完成,处于审评决策阶段,最终结果将决定其能否获批上市、发补或退审。
中美两国在干细胞药物研发上均针对急性移植物抗宿主疾病,但艾米迈托赛注射液使用的人脐带间充质干细胞具有增殖力强、免疫原性低的优势,在治疗中或更有效,且取材、培养和扩增相对简便,利于规模化生产。其临床适应症为激素治疗无效的急性移植物抗宿主病(aGVHD),这是一种发生于同种异体造血干细胞移植(HSCT)后的严重疾病,主要累及皮肤、胃肠道和肝脏,其中胃肠道急性移植物抗宿主病(GI aGVHD)是致死主因。
早在 2024 年初,CDE 发布相关指导原则,预示国内首个干细胞药物将针对移植物抗宿主病,当时铂生卓越的 “艾米迈托赛注射液” 是唯一符合该适应症的药物。6 月 12 日被纳入优先审评名单,6 月 25 日提交 NDA,6 月 27 日成功受理。此次首款干细胞新药申请上市意义重大,但需通过严格审评,其疗效与安全性有待进一步验证。若成功上市,将为 aGVHD 患者带来新希望,推动干细胞治疗领域发展创新。

干细胞疗法作为新兴技术潜力巨大,可应对多种疑难病症,但研发审批面临安全性、有效性、生产工艺及质量控制等难题。凭借自我更新和分化能力,干细胞在细胞治疗领域地位重要,前景广阔。当前细胞治疗正掀起医学变革,改变全球医疗产业格局。

全球多国已有干细胞药物上市,我国虽尚未有产品获批,但已将干细胞技术及再生医学纳入 “十四五” 规划和中长期发展纲要,政策支持强劲,前景可期。随着科研深入与技术进步,未来有望出现更多干细胞治疗药物,但必须严格遵循法规和伦理准则,确保安全有效。公众也应理性看待干细胞疗法,避免盲目跟风。科研、监管与公众认知共同作用,将助力该领域稳健、持续发展,为人类健康事业贡献更多力量。
编辑|LiYe.ZG
审核|Geng.ZG

