
慢性肝病构成了一个全球性的公共卫生挑战,据权威统计数据显示,全球范围内共有8.1亿人罹患此病,且每年不幸导致约200万人失去生命。其中,多数肝病会逐渐演变为肝纤维化(hepatic fibrosis, HF),这是肝脏历经长期损伤与修复循环所形成的一种复杂且难以根治的病理状态,其发病机制一直是医学界亟待探索与破解的关键难题。然而,近年来,随着科学家们对外泌体——这一微小却充满奥秘的生命信息传递者的深入探究,一种全新的治疗途径应运而生,为肝纤维化这一长期困扰医学界的难题点亮了希望之光。
肝纤维化:健康的潜在威胁与挑战
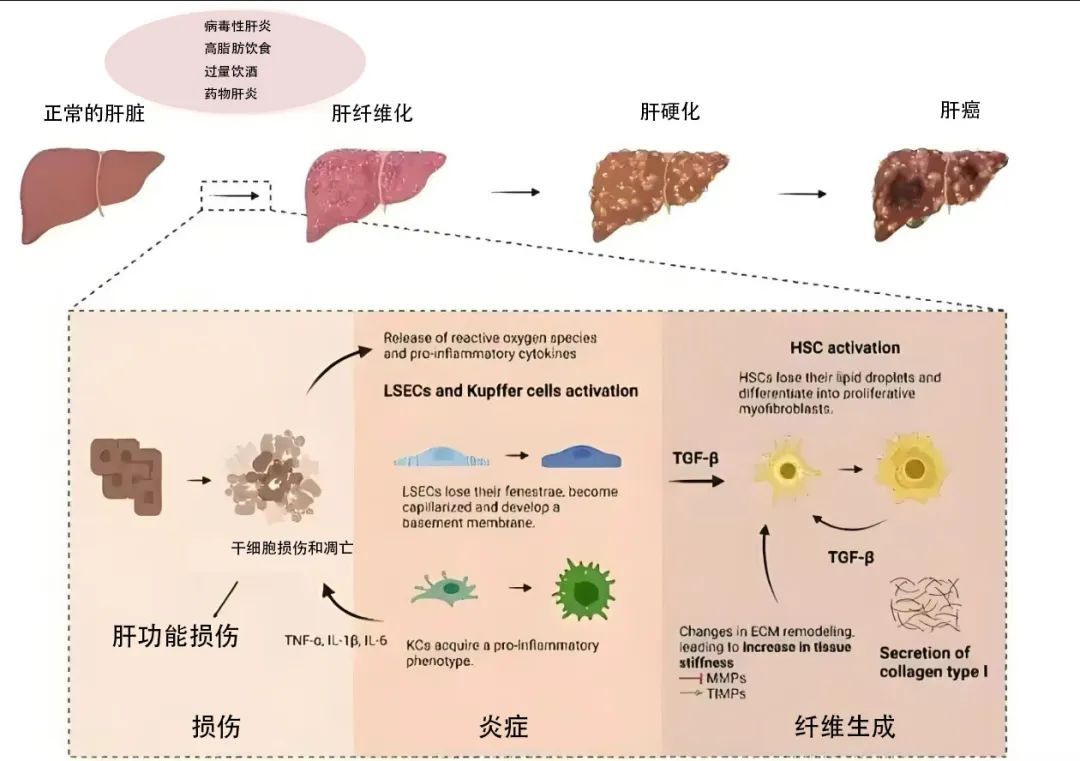
在HF(肝纤维化)的形成过程中,肝细胞会受到多种因素的刺激,包括病毒感染、过量酒精摄入、非酒精性脂肪沉积、自身免疫反应、药物诱导、胆汁淤积以及代谢性疾病。这些刺激因素会触发细胞内炎症反应的“风暴”,并促使肝细胞分泌多种细胞因子,这些细胞因子进一步作用于肝星状细胞(HSC),诱导其转化为成纤维细胞,从而导致细胞外基质(EXM)的异常累积,并减少了对这些基质的降解物质的合成。这一系列反应最终会形成纤维状瘢痕,即肝纤维化,若不加以控制,可能逐步演变为肝硬化,甚至发展为肝癌。
全球范围内,肝纤维化患者数量庞大,且呈逐年上升趋势。这一疾病不仅严重影响肝脏的正常功能,导致贫血、乏力、黄疸等症状,还极大地增加了肝癌的风险。因此,探索有效的治疗方法,对于改善肝纤维化患者的生活质量,乃至挽救生命,都具有极其重要的意义。
外泌体:生命信使的奥秘与潜力
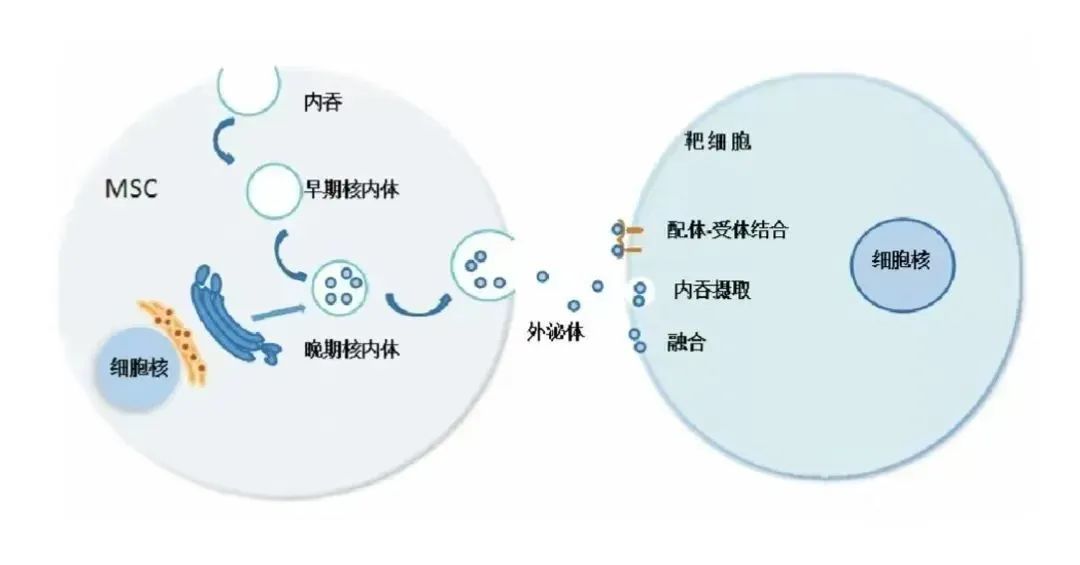
外泌体,这些由细胞分泌的直径约为30-150纳米的小囊泡,是细胞间物质和信息传递的重要载体。它们广泛存在于多种体液中,如血液、尿液、乳汁等,携带着蛋白质、脂类、核酸(包括DNA、RNA)等关键信息,通过影响细胞间的相互作用,参与调节各种生理和病理过程。
在肝纤维化领域,外泌体展现出了巨大的治疗潜力。它们能够调控肝星状细胞的功能,通过影响肝星状细胞的活化状态,在肝纤维化的发生、发展和缓解中发挥关键作用。不同来源的外泌体,如肝细胞、肿瘤和间充质干细胞等,通过不同的机制作用于肝星状细胞,从而影响肝纤维化的进程。
外泌体在肝纤维化中的作用机制
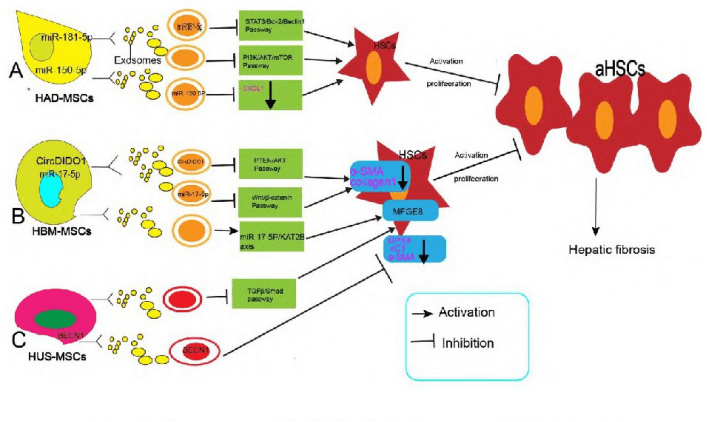
(一)调控肝星状细胞功能
肝细胞来源的外泌体在肝损伤过程中发挥着重要作用。研究表明,这些外泌体能够携带特定类型的RNA,影响肝星状细胞的活化状态。例如,肝细胞分泌的外泌体中的miRNA可以通过调节肝星状细胞中的信号通路,抑制其活化并促进凋亡,从而减轻肝纤维化。
此外,肿瘤来源的外泌体也在肝纤维化中发挥重要作用。例如,胰腺癌衍生的外泌体可以通过诱导脂肪细胞去分化,促进肿瘤的发生和侵袭,同时影响肝星状细胞的活化状态。这些发现为理解肿瘤与肝纤维化之间的相互作用提供了新的视角。
间充质干细胞来源的外泌体更是治疗肝纤维化的潜力之星。研究表明,间充质干细胞衍生的外泌体可以通过携带特定的miRNA和circRNA等分子,抑制肝星状细胞的活化并促进其凋亡,从而减轻肝纤维化。这些外泌体还可以通过调节免疫细胞的功能和减轻炎症反应来进一步改善肝纤维化。
(二)介导细胞间串扰与信号传导
外泌体在细胞间串扰中扮演着重要角色。它们可以作为细胞间信息传递的媒介,将一种细胞的信息传递给另一种细胞。在肝纤维化过程中,外泌体在肝巨噬细胞和肝星状细胞之间的串扰中发挥着关键作用。
例如,巨噬细胞来源的外泌体可以通过携带特定的miRNA或蛋白质来影响肝星状细胞的功能。这些外泌体可以抑制肝星状细胞的活化并促进其凋亡,从而减轻肝纤维化。此外,松弛素诱导的巨噬细胞外泌体也被发现具有缓解肝纤维化的效果。这些发现为理解外泌体在细胞间信号传导中的作用提供了新的思路。
(三)激活肝星形细胞TLR3与非编码RNA的作用
非编码RNA作为Toll样受体3(TLR3)的激活剂,在肝损伤和纤维化过程中发挥着重要作用。研究表明,在CCl4诱导的急性肝损伤和早期肝纤维化过程中,肝细胞分泌的外泌体能够显著增加野生型肝星状细胞中IL-17A、IL-1β和IL-23的表达,而这一效应在TLR3敲除的肝星状细胞中并不存在。这一发现进一步揭示了外泌体在肝纤维化发生和发展中的复杂机制,并提示TLR3可能是外泌体治疗肝纤维化的新靶点。
结论与未来展望
外泌体在肝纤维化的诊断和治疗中展现出了巨大的潜力。它们不仅为肝纤维化的早期诊断提供了新的方向,还通过多种途径参与肝纤维化的治疗,为这一顽疾的治疗带来了新的希望。然而,外泌体在肝纤维化治疗领域仍然面临着一些挑战和问题。
首先,外泌体的分离和纯化技术需要进一步优化。目前,外泌体的分离和纯化仍然存在一定的困难和挑战,如产量低、纯度不高等。这限制了外泌体在肝纤维化治疗中的广泛应用。因此,研究者们需要不断探索新的分离和纯化技术,以提高外泌体的产量和纯度。
其次,外泌体的稳定性和生物活性需要进一步提高。外泌体在体内的稳定性和生物活性是影响其治疗效果的关键因素之一。为了提高外泌体的稳定性和生物活性,研究者们可以尝试通过基因工程等手段对外泌体进行改造和优化。
此外,外泌体的作用机制还需要深入研究。尽管近年来研究者们在外泌体治疗肝纤维化方面取得了一些进展,但外泌体的具体作用机制仍然不完全清楚。因此,研究者们需要继续深入探索外泌体的作用机制,为其临床应用提供理论支持。
未来,我们期待看到更多关于外泌体在肝纤维化治疗中的研究成果。通过不断优化分离和纯化技术、提高外泌体的稳定性和生物活性以及深入研究外泌体的作用机制,我们有望实现外泌体在肝纤维化临床治疗中的广泛应用。相信随着技术的不断进步和研究的不断深入,外泌体将成为肝纤维化治疗领域的重要力量,为无数患者带来生命的曙光和新的希望。
参考文献
[1]Marcellin P, Kutala BK. Liver diseases:A major, neglected global public health problem requiring urgent actions and large-scale screening[J]. Liver Int, 2018, 38,1:2-6.
[2] Zhang Z, Shang J, Yang Q, et al. Exosomes derived from human adipose mesenchymal stem cells ameliorate hepatic fibrosis by inhibiting PI3K/Akt/mTOR pathway and remodeling choline metabolism[J]. J Nanobiotechnology, 2023, 21(1):29.
[3] Ma J, Li Y, Chen M, et al. hMSCs-derived exosome circCDK13inhibits liver fibrosis by regulating the expression of MFGE8through miR-17-5p/KAT2B[J]. Cell Biol Toxicol, 2023, 39(2):1-22.
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|Ning.ZG
审核|Geng.ZG

