
近日,由吴德沛教授团队与上海优卡迪生物医药科技有限公司共同完成的 IL-6 基因沉默赋能的 CD19 CAR-T(ssCART-19)的研究数据发布于国际权威血液学期刊《Blood Cancer Journal》,论文题为「IL-6 knockdown anti-CD19 CAR-T cells (ssCART-19) for patients with relapsed or refractory acute lymphoblastic leukemia: phase 1 trial」复发或难治性急性淋巴细胞白血病患者的IL-6敲低抗CD19嵌合抗原受体T细胞疗法(ssCART-19):I期临床试验。该研究是国家药品监督管理局药品审评中心批准的 I 期研究。

该研究报道了全球首个在靶向基础上增加 IL-6 沉默赋能元件的 CD19 CAR-T 产品治疗难治/复发急性 B 淋巴细胞白血病(包括中枢神经系统白血病)的 I 期研究成果,其安全性和疗效优异,有望为更多患者带来新的治疗选择和生存希望。
该研究选取了17位年龄在18-65岁之间,确诊为r/r B-ALL,形态骨髓母细胞≥5%,流式细胞术上CD19表达,东部肿瘤合作组的表现状态为0-1,器官功能正常的患者。
患者在5至−3天内接受了氟达拉滨(30mg/m2/天)和环磷酰胺(300mg/m2/天)的淋巴细胞清除术。CAR-T细胞以总剂量的10%、30%和60%分次输注给药。在剂量递增阶段,ssCART-19的总剂量为1 × 106 (低),5 × 106 (中等),或1 × 107 (高)细胞/kg。在剂量扩大阶段,患者接受了根据升级期间观察到的安全性和有效性特征确定的第2阶段推荐剂量。
患者在5至−3天内接受了氟达拉滨(30mg/m2/天)和环磷酰胺(300mg/m2/天)的淋巴细胞清除术。CAR-T细胞以总剂量的10%、30%和60%分次输注给药。在剂量递增阶段,ssCART-19的总剂量为1 × 106 (低),5 × 106 (中等),或1 × 107 (高)细胞/kg。在剂量扩大阶段,患者接受了根据升级期间观察到的安全性和有效性特征确定的第2阶段推荐剂量。
共有31名r/r B-ALL患者接受了资格筛查。10名患者筛查失败,21名患者连续入选并接受了单采。ssCART-19已成功为所有入选患者制造。四名患者因肺部感染失控而未接受输液(n = 2),脑出血(n = 1),或疾病进展(n = 1). 最终,17名患者输注了ssCART-19。图1A总结了患者的处置情况。
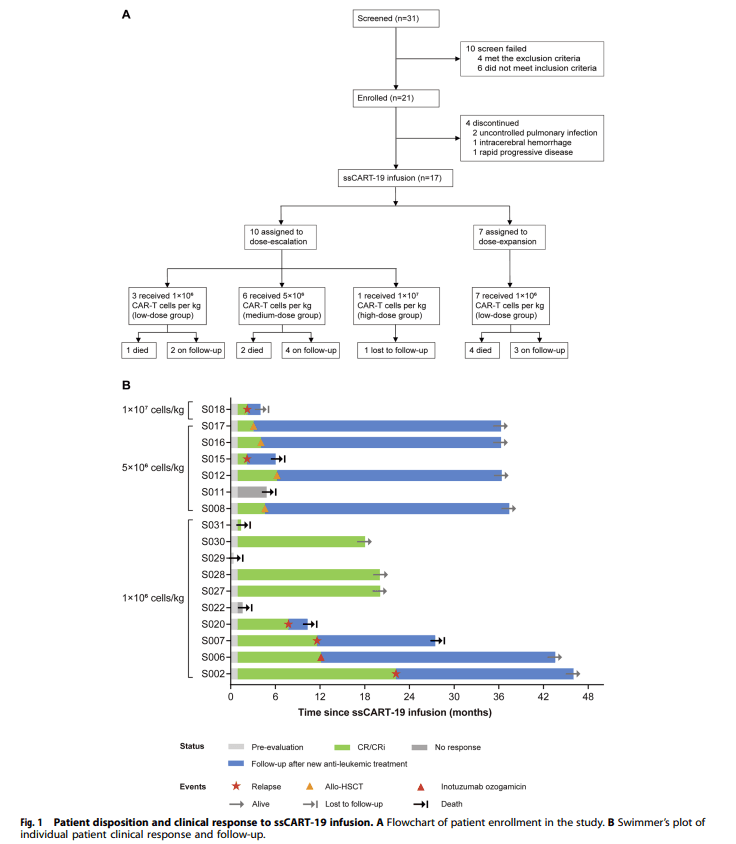
表1和补充表1总结了基线患者特征。参与者的中位年龄为39岁(四分位数间距[IQR],20-51)。骨髓母细胞百分比中位数为18.0%(IQR,5.0-53.3%),76.5%的患者在输注前表现出超过5%的母细胞。17例患者中有16例白血病细胞CD19表达≥93.7%;1例患者表达降低(21.8%)。在8名患者(47.1%)中发现了不良风险遗传学,包括突变的TP53、BCR::ABL1基因融合和BCR::ABL1样特征。
参与者中未观察到DLT。所有患者都经历了至少一次与ssCART-19相关的不良事件(补充表2)。最常见的3级或更高级别不良事件是血液学:淋巴细胞减少症(16/17,94.1%)、中性粒细胞减少症(15/17,88.2%)、白细胞减少症。两名患者在输注ssCART-19后因长期严重中性粒细胞减少而死于感染性休克。所有患者均出现B细胞再生障碍性贫血,中位发病时间为0.0天(IQR,0.0-2.0),中位持续时间为90.0天(IQR,74.5-183.8)。四名患者在最后一次随访时表现出持续的B细胞再生障碍。
17名患者中有13名(76.5%)出现CRS,3名患者(17.6%)出现3级CRS,未观察到4级事件。在剂量递增期间,低、中、高剂量队列中3级CRS的发生率分别为0%(0/3)、33.3%(2/6)和0%(0/1)。在剂量扩大后,低剂量队列中的3级CRS率为10%(1/10),详见补充表3。

所有CRS病例在常规干预后迅速缓解,包括托珠单抗(9名患者)、糖皮质激素(8名患者)或两者的组合(8名病人)。这些患者中的大多数肿瘤负担很高,骨髓母细胞百分比中位数为49.0%(IQR,22.0-66.5%)。在所有患者中均未观察到神经毒性,包括筛查时患有中枢神经系统白血病(CNSL)的患者。未发现细胞因子峰值水平与CRS严重程度或ssCART-19给药剂量之间存在相关性(补充图1和2)。
在剂量递增期间,低剂量组的所有三名患者(100%)、中剂量组的六名患者中的四名(66.7%)和高剂量组的一名患者(0%)在输注后3个月内均达到CR或CRi。根据剂量递增期间观察到的安全性和有效性,另外7名患者被纳入低剂量组(1×10⁶ 细胞/kg)作为扩增队列的一部分。在剂量扩大后,11/17名患者(64.7%)在3个月时达到了目标缓解,其中8名患者达到完全缓解(47.1%),3名患者出现完全缓解(17.6%),所有患者均为微小残留病(MRD)阴性。游泳运动员的个体反应和生存结果如图1B所示。
在这项1期试验中,ssCART-19在输注后3个月的ORR为64.7%。76.5%的患者出现CRS,在所有剂量水平中,17.6%的患者出现3级CRS,在低剂量队列中为10%,明显低于常规抗CD19 CAR-T细胞疗法的报告率。输注后第28天的ORR为82.4%,第3个月为64.7%,同时MRD阴性缓解率也在增加。低剂量队列在3个月时实现了80%的ORR,具有良好的安全性。
总之,ssCART-19在r/r B-ALL患者中表现出良好的耐受性和有希望的疗效。这些发现将ssCART-19定位为高肿瘤负荷患者的潜在治疗选择。
CD19靶向嵌合抗原受体修饰T细胞(CAR-T)疗法是一种针对复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)的革命性免疫疗法,其有效率可达60%~80%
结 语
吴德沛教授寄语:“当我们学会与免疫系统对话而非对抗,细胞治疗才真正迈向精准可控的时代。”
ssCART-19疗法的成功绝非偶然,它象征着免疫细胞治疗从"野蛮生长"迈向"智慧静默"的新纪元——通过基因层面的精准干预,人类首次在白血病战场上实现了对细胞因子风暴的主动驯服。这不仅让88.2%的复发难治患者重获生机,更将高昂的ICU监护成本转化为寻常门诊的可行路径。未来,当沉默的基因序曲在实体瘤领域奏响,这项东方智慧驱动的创新,必将在全球抗癌史诗中刻下"以柔克刚"的华章。科技之光,终将照亮每个曾被绝望笼罩的生命转角。
参考文献
1:https://www.nature.com/articles/s41408-025-01397-4
免责声明:本文旨在科普相关知识,不作为医疗指导意见
编辑|Zhang.ZG
审核|Geng.ZG

