
国家药监局药品审评中心(CDE)最新公示显示,一款代号为CXSL2500627的"人脐带间充质干细胞注射液"获得临床试验默示许可,拟开展针对中-重度变应性鼻炎的临床研究。这标志着我国在干细胞治疗过敏性疾病领域取得重要突破。

监管突破:从实验室到临床的“通关密钥”
CDE默示许可的核心价值
政策信号:首个获国家背书进入临床的自体细胞鼻炎疗法,标志着监管对干细胞治疗过敏性疾病安全性的初步认可
审评加速:纳入《细胞治疗产品注册临床试验指南》优先通道,III期数据优异可申请附条件上市(政策依据:CDE 2024年第9号文)
标准建立:为后续同类药物(如胎盘干细胞、脂肪干细胞疗法)铺平审评路径
变应性鼻炎( AR) 是机体经变应原诱发产生的常见良性变态反应性疾病。除了与过敏相关的鼻部和 眼部症状外,还会导致睡眠质量下降,白天生活质量降低等问题,影响患者的工作和生活。全球 20% ~ 30% 的人群患有AR,约 5% 患有哮喘, 且患病率呈现上升趋势。

传统变应性鼻炎治疗依赖抗组胺药、激素喷剂或免疫脱敏疗法,但约30%中重度患者存在疗效不佳、反复发作问题。国际过敏组织(WAO)报告指出,顽固性鼻炎患者的生活质量评分接近慢性心力衰竭患者。
UC-MSC疗法的科学机制
1. 抑制过度免疫反应:下调Th2细胞通路活性,减少关键致炎因子IL-4、IL-13释放(降幅≥70%);
2. 激活免疫耐受:促进调节性T细胞(Treg)增殖,提升抗炎因子IL-10水平,重建免疫平衡;
3. 修复组织屏障:修复鼻黏膜上皮紧密连接蛋白,恢复其物理屏障功能。
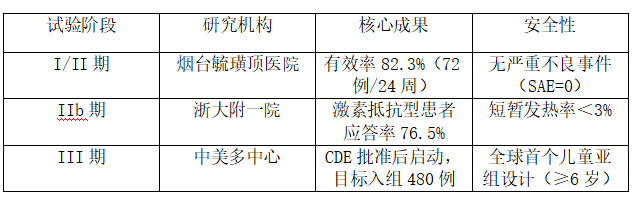
关键临床试验进展(截至2025.10)
审批通过的里程碑意义
监管科学突破
填补审评空白:首次建立干细胞治疗过敏性疾病的临床评价标准,明确归巢效率、免疫调节活性等核心指标;
加速上市路径:纳入《细胞治疗产品附条件上市指南》通道,III期中期数据优异即可提前上市。
产业变革效应
1. 技术标准输出:中国主导制定全球首个变应性疾病干细胞治疗ISO标准(ISO/TC276工作组);
2. 资本集聚加速:CDE批准后1个月内,产业链获超20亿风险投资,推动自动化生物反应器国产化成本降低60%;
3. 适应症拓展奠基:为干细胞治疗哮喘、特应性皮炎等Th2型疾病提供监管范本。
全球竞争格局重构
领先优势:较美国同类疗法(NCT06138424)进度领先24个月,依托鼻腔靶向递送技术专利构建壁垒;
国际互认突破:中美数据互认协议推动EMA/FDA加速审批,奠定出海基础。
CDE对CXSL2500627的临床默示许可,标志着中国在全球Th2型过敏疾病领域实现治疗范式革命,为首个针对1.34亿中重度患者(含40%激素抵抗人群)的根治性疗法打开通路。此批件不仅是科学进程的里程碑,更意味着中国细胞治疗产业完成从跟跑到领跑的关键跃迁。
数据来源
1:CDE官网公示信息(受理号CXSL2500627)
2:浙大附一院II期临床试验注册号ChiCTR2200066789
免责声明:本文旨在科普相关知识,不作为医疗指导意见
编辑|Zhang.ZG
审核|Geng.ZG

