
2025年8月2日,中国医科大学附属第一医院和沈阳药科大学药学院的科研团队,在国际知名期刊《Nature》上发表了一篇标题为《Chimeric exosomes-derived immunomodulator restoring lymph nodes microenvironment for sensitizing TNBC immunotherapy》嵌合型外泌体衍生免疫调节剂可重塑淋巴结微环境以增强三阴乳腺癌免疫治疗敏感性的文章。

临床研究发现,病理学检测显示活性氧(ROS)水平升高和脂质稳态失衡,与TNBC患者免疫抑制淋巴结微环境中树突状细胞(DCs)功能障碍密切相关,这会严重影响免疫治疗效果。基于此,该研究团队开发了一种嵌合外泌体衍生的免疫调节剂:该制剂采用多硫键桥接介孔二氧化硅作为ROS清除剂和响应载体核,装载脂质调节剂妥卡霉素,并包裹由DCs来源外泌体与沙门氏菌外膜囊泡组成的嵌合外泌体。
该研究筛选出20,959例乳腺癌患者,最终选取2849例完整记录年龄、种族、肿瘤分级、TNM分期、原发肿瘤部位及治疗详情的患者进行分析。采用卡方检验分析基线特征,通过单变量Cox比例风险模型评估潜在风险或保护因素,变量包括年龄、种族、肿瘤分级、TNM分期、原发肿瘤部位及新辅助治疗。
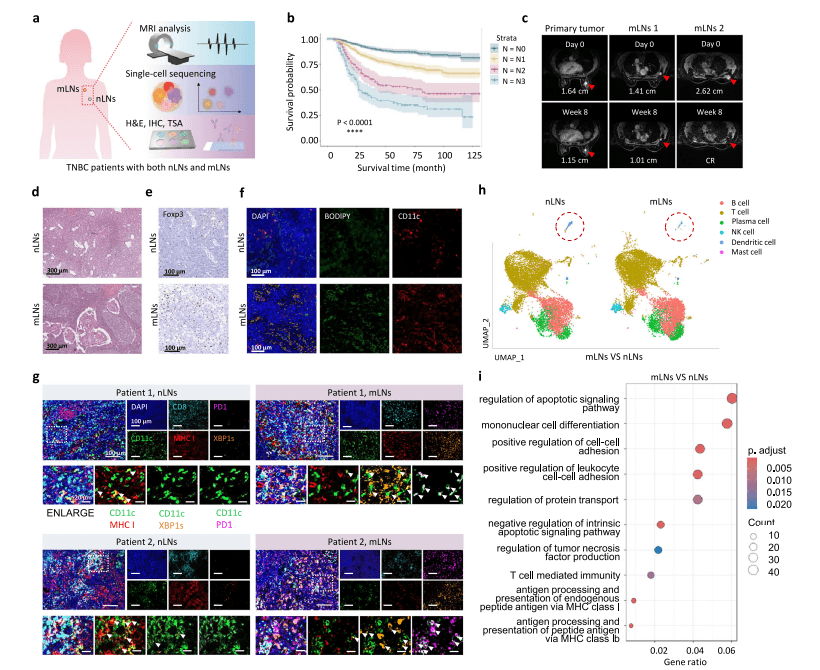
TNBC患者原发肿瘤及转移淋巴结的MRI影像,红色箭头标示病灶区域。d 通过H&E染色对比淋巴结与转移淋巴结的组织病理学特征。e淋巴结与转移淋巴结中Foxp3蛋白的免疫组化(IHC)检测结果对比。
研究表明,通过靶向调控脂质代谢异常——特别是降低DCs中XBP1s基因表达——可能恢复其抗原呈递功能,从而逆转髓系淋巴结中的免疫抑制状态。这种治疗策略有望改善三阴性乳腺癌(TNBC)患者的免疫治疗效果。
GEO数据库获取了乳腺癌单细胞测序数据集(GSE158399),该数据集包含同一患者匹配的原发性乳腺癌、转移性淋巴结(mLNs)及阴性淋巴结(nLNs)的单细胞转录组数据。
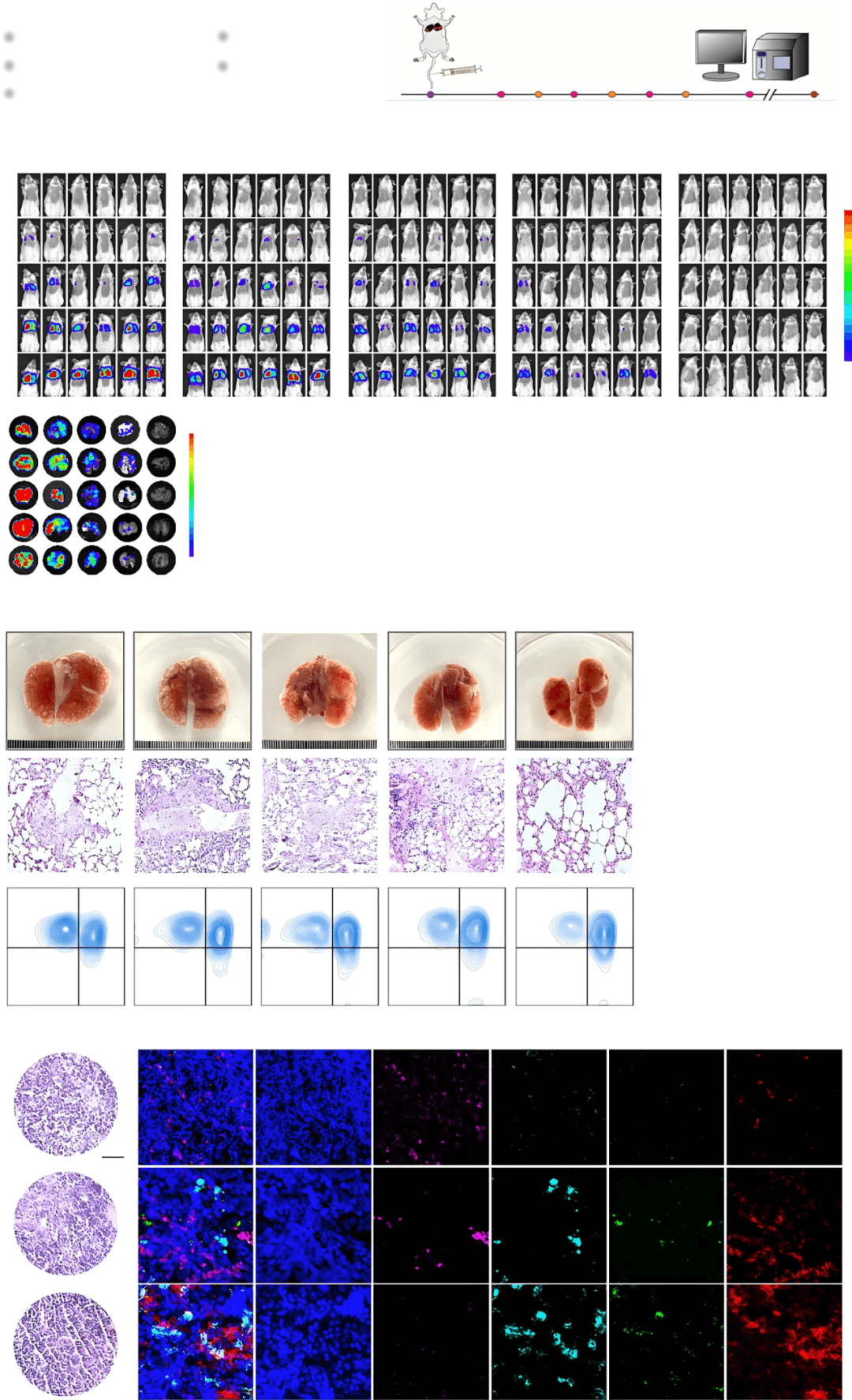
该免疫调节剂显著增强了TNBC对免疫治疗的应答能力,对原发肿瘤和转移灶均表现出强效抑制作用,同时促进淋巴结内中心记忆T细胞数量的显著增加,从而维持持续的抗肿瘤免疫。本研究通过优化TNBC的淋巴结微环境,为转化免疫治疗提供了强有力的策略。
三阴性乳腺癌(TNBC)是乳腺癌的一种极具侵袭性的特殊亚型,主要特征是癌细胞缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)的表达。以下是其核心特点:
1. 基本定义
"三阴性":指肿瘤的病理检测结果为:
ER阴性:雌激素受体缺失;
PR阴性:孕激素受体缺失;
HER2阴性:无HER2蛋白过度表达或基因扩增。
这类乳腺癌占所有乳腺癌的约10%–15%。
2. 与其他类型的区别
激素受体阳性型:可通过内分泌治疗(如他莫昔芬)阻断激素信号;
HER2阳性型:可用靶向药(如曲妥珠单抗)抑制HER2通路;
三阴性型:缺乏以上靶点,无法采用内分泌或抗HER2治疗。
3. 临床特点
侵袭性强:多见于年轻女性(尤其是<40岁),生长速度快,易早期转移(常转移至肺、脑);
治疗受限:化疗是主要手段,但易复发且疗效有限;
预后较差:5年内复发风险高于其他亚型,生存率较低;
分子异质性:包含多个亚群(如基底样型、免疫激活型),部分患者对免疫治疗敏感。
免疫疗法通过激活患者自身免疫系统来改善生存预后,已成为TNBC治疗领域的重要突破。
外泌体治疗三阴性乳腺癌的核心机制
STEP 1微环境修复
清除活性氧(ROS)并调节脂质代谢,恢复淋巴结中树突状细胞功能。
临床数据显示,联合治疗可使CD8+ T细胞活化水平提升3倍以上。
STEP 2免疫激活
嵌合外泌体携带肿瘤抗原,直接激活T细胞应答
沙门氏菌囊泡成分通过TLR4通路促进巨噬细胞极化,增强免疫反应。
STEP 3靶向递送
表面归巢肽使载体富集于转移性淋巴结,局部药物浓度达全身5-倍。
动物模型中,联合治疗使肿瘤完全消退率提高40%,且无自身免疫副作用。
结 语
《科学》杂志评价:"外泌体不仅是生物快递员,更是乳腺癌治疗的重编程工程师"。当纳米科技与癌症生物学深度交融,人类正迎来"以癌治癌"的崭新时代。
外泌体作为天然载体,以其低免疫原性、高效靶向递送能力和微环境调控特性,为三阴性乳腺癌(TNBC)的治疗困境提供了全新突破口。当前研究已证实,工程化外泌体在载药化疗、基因沉默、免疫激活等方面展现出显著潜力。未来,随着单细胞测序与AI药物设计的深度融合,外泌体疗法有望从“广谱轰炸”走向“精准狙击”,最终实现TNBC从“无药可治”到“可治可控”的转化医学革命。
参考文献
1. nature.com/articles/s41467-025-62543-x
免责声明:本文旨在科普相关知识,不作为医疗指导意见
编辑|Zhang.ZG
审核|Geng.ZG

