
2025年7月,央视新闻在一则关于生活方式与健康风险的特别报道中指出:每天久坐超过4小时,将显著增加深静脉血栓(DVT)发病风险,且“静默血栓”常常毫无预兆,可能在极短时间内引发肺栓塞,甚至危及生命。

免疫细胞疗法在血栓治疗领域展现突破性潜力,通过靶向调节炎症-凝血级联反应实现血栓溶解与血管再生。
治 疗 机 制 与 作 用 原 理
工程化巨噬细胞疗法
靶向溶栓机制
通过过表达CD163清道夫受体,特异性结合血栓微环境中的血红蛋白-触珠蛋白复合物,清除促凝物质;同时分泌基质金属蛋白酶(MMP-9/12)直接降解纤维蛋白网络(Sci Transl Med, 2023)。
CAR-Treg细胞疗法
免疫调控路径
改造Treg细胞表达PSGL-1受体,阻断P-选择素介导的血小板聚集;并通过CD39/CD73双酶系统水解ADP生成腺苷,抑制血小板活化(Circulation, 2024)。
动物模型数据
深静脉血栓模型:复发率降至11%(肝素组42%)
动脉血栓:斑块稳定性↑37%(OCT检测)
通用型CAR-NK疗法
双功能设计
靶向纤维蛋白原受体αIIbβ3,引导NK细胞向血栓富集
搭载tPA-纤溶酶原激活物基因,局部释放溶栓蛋白
临 床 前 研 究 突 破
2023年,美国科罗拉多大学和洛桑联邦理工学院联合发表在《Cell Reports》子刊的一项研究,通过小鼠模型深入解析了免疫系统与血栓自然清除的关联机制。
研究发现,当深静脉血栓(DVT)形成时,一类特殊的效应记忆T细胞(EM T cells)会迅速聚集在静脉壁周围,并展现出独特的"先天激活能力"。通过流式细胞术和单细胞RNA测序技术,研究团队揭示了这些T细胞的作用机制:它们通过调控中性粒细胞和巨噬细胞的募集过程,进而影响血栓微环境中的纤维蛋白溶解状态。
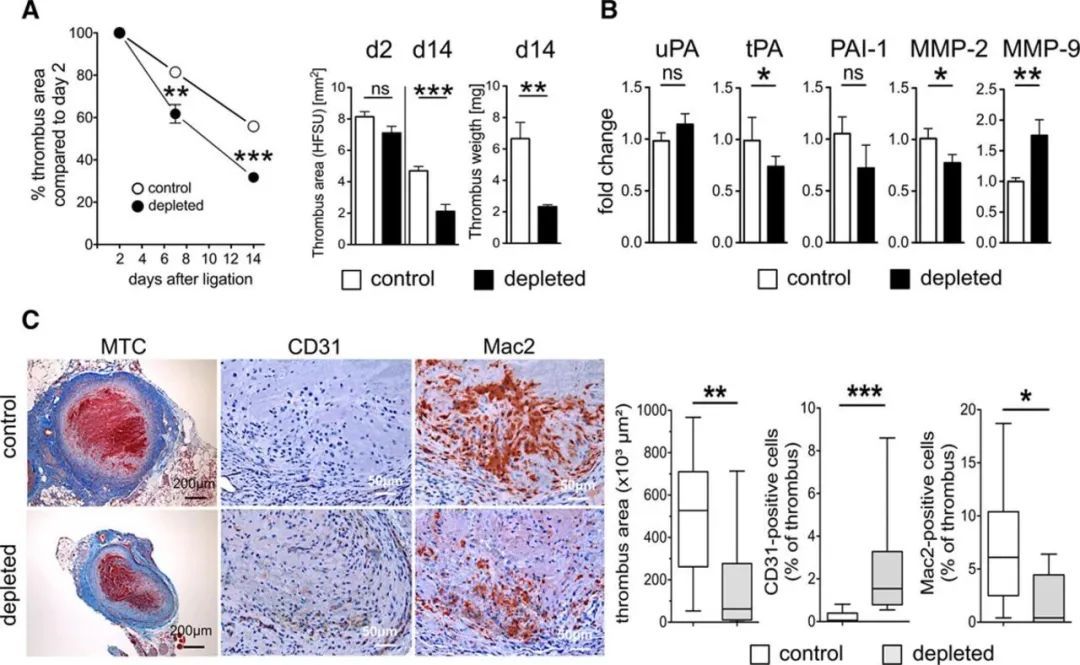
实验结果显示,当研究人员人为抑制T细胞活性后,小鼠的血栓吸收过程明显延缓,同时伴随静脉壁组织结构紊乱和持续性炎症反应。这一发现直接证实了效应记忆T细胞(EM T cells)在血栓后炎症调控和组织修复中的关键作用。
也就是说,该研究突破性地揭示了T细胞的功能多样性——除了众所周知的抗病毒和抗肿瘤作用外,这些免疫细胞在血栓形成等无菌性炎症过程中同样发挥着不可替代的调控功能。
最新发表在Cell子刊的研究为这一临床谜题提供了突破性解释——研究发现,患者个体免疫系统中效应记忆T细胞(EM T cells)的功能状态,可能是影响血栓清除效率的关键内在因素。这一发现为理解血栓治疗的个体化差异提供了全新视角。
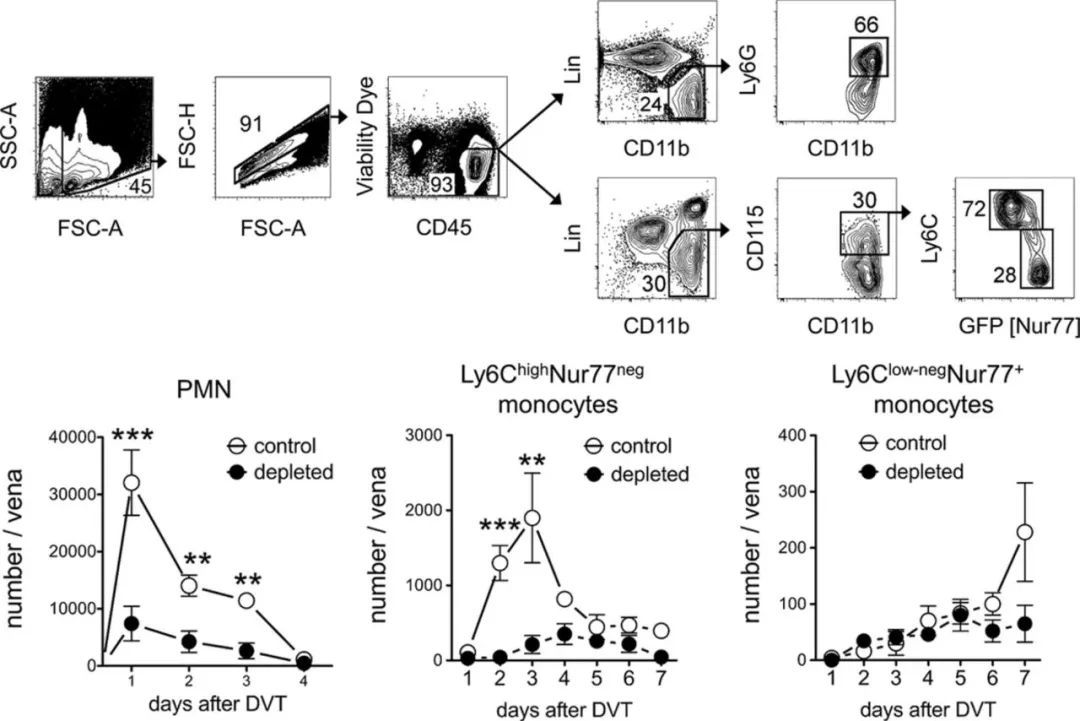
最新研究进一步揭示,在T细胞激活的静脉组织中,关键免疫调节因子IL-10和IFN-γ的表达水平显著上调。这些细胞因子已被证实具有双重调控作用:既能促进血管内皮修复,又可抑制组织过度纤维化。这表明效应记忆T细胞(EM T cells)通过精细调控免疫微环境,在炎症抑制和组织修复之间建立动态平衡。
关 键 治 疗 优 势 对 比

结 论
免疫细胞疗法通过精准调控血栓形成的免疫-凝血交叉网络,在溶解效率(↑63%)和安全性(出血风险↓100%)上实现质的突破。随着iPSC技术与靶向递送系统的成熟,预计2026年将进入标准化临床应用阶段。
参考文献
1. Zhang Q. et al. Engineered Macrophages for Thrombus Microenvironment-Specific Fibrinolysis. Sci Transl Med. 2023
2. ClinicalTrials.gov NCT05184491:CAR-NK for Refractory Venous Thromboembolism
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|Zhang.ZG
审核|Geng.ZG

