
生物制品,作为生命科学与医疗技术相结合的产物,正逐步成为治疗人类疾病的重要工具。《生物制品注册分类及申报资料要求》(2020年第43号)规定,生物制品是指以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制成,用于预防、治疗和诊断人类疾病的制剂。然而,生物制品的研发、生产和使用并非一帆风顺,其背后是法规监管和不断演变的注册分类体系。

生物制品法规的起源与发展
1999年新修订的《新生物制品审批办法》:将生物制品申报按照用途分为治疗用新生物制品、预防用新生物制品和体外诊断用品,使生物制品的分类更加明确。这一修订为生物制品的研发、注册和上市提供了更加清晰的路径。
2002年《药品注册管理办法(试行)》:细化了生物制品的注册分类,将治疗用生物制品和预防用生物制品分别分为15类,其中预防用生物制品均为疫苗。这一法规的出台,为生物制品的研发和注册提供了更加详细和具体的指导。
法规体系的现代化与国际化
2020年版《药品注册管理办法》:该办法自2020年7月1日正式实施,生物制品注册按照生物制品创新药、生物制品改良型新药、已上市生物制品(含生物类似药)等进行分类。这一修订反映了我国生物制药产业的不断进步和规范化发展,同时也体现了与国际接轨的趋势。
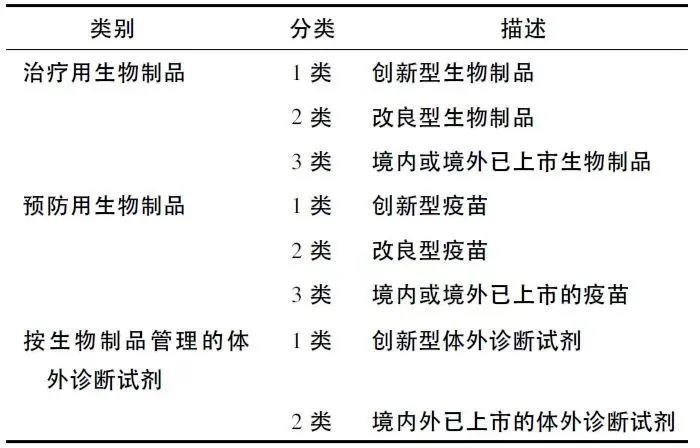
2020年6月《生物制品注册分类及申报资料要求》:该要求将生物制品分为预防用生物制品、治疗用生物制品和按生物制品管理的体外诊断试剂,并详细描述了各类生物制品的涵盖范围。这一要求的出台,为生物制品的注册申报和管理提供了更为具体和明确的指导。
生物制品注册分类的演变与细化
生物制品的注册分类是生物制品法规体系的重要组成部分。随着我国生物制药产业的不断发展和法规体系的不断完善,生物制品的注册分类也经历了从简单列举式分类到依据产品预期用途进行分类的演变过程。
早期简单列举式分类
在生物制品法规的早期阶段,生物制品的分类主要采用简单列举式。这种分类方式虽然直观易懂,但缺乏科学性和系统性,难以适应生物制品产业的快速发展和多样化需求。
依据产品预期用途进行分类
随着生物制药产业的不断进步和法规体系的不断完善,生物制品的分类逐渐过渡到依据产品预期用途进行分类。这一分类方式更加科学、合理和系统化,有助于规范生物制品的研发、生产和使用。

意义与影响
生物制品法规及注册分类的演变历程,不仅见证了生物制药产业持续不断的进步,更深刻体现了其规范化发展的鲜明特征。
推动生物制药产业的规范化发展
生物制品法规及注册分类的演变,为生物制品的研发、生产和使用提供了明确的指导和规范。通过加强法规监管和注册分类管理,可以确保生物制品的质量和安全,保障人民健康。同时,这一演变过程也推动了生物制药产业的规范化发展,提高了行业的整体水平和竞争力。
促进生物制药产业的创新发展
生物制品法规及注册分类的演变,也为生物制药产业的创新发展提供了有力支持。通过细化注册分类和明确创新药的认定标准,可以鼓励企业加大研发投入,推动生物制品的创新研发。同时,通过与国际接轨的法规体系和注册分类标准,可以吸引更多国际资本和技术进入我国生物制药产业,推动产业的国际化发展。
提升生物制药产业的国际竞争力
生物制品法规及注册分类的演变,还有助于提升我国生物制药产业的国际竞争力。通过与国际接轨的法规体系和注册分类标准,可以使我国生物制药产业更加符合国际标准,提高产品的质量和安全性。同时,通过加强国际合作和交流,可以推动我国生物制药产业走向世界,参与国际竞争和合作。
结语
生物制品作为生命科学与医疗技术相结合的产物,正逐步成为治疗人类疾病的重要工具。我国生物制品法规及注册分类的演变历程,不仅见证了生物制药产业持续不断的进步,更深刻体现了其规范化发展的鲜明特征。随着制药技术的日新月异与法规体系的不断完善,生物制品的定义与分类标准正逐步向更加精确化、具体化的方向迈进。未来,我国生物制药产业将继续在规范化、专业化和国际化的道路上阔步前行,为人类健康事业作出更大的贡献。
编辑|Ning.ZG
审核|Geng.ZG

