
食管癌作为一种常见的恶性肿瘤,严重威胁着人类的健康。传统的治疗方式如手术、放疗和化疗等虽然取得了一定的成果,但在改善患者预后、减轻治疗副作用等方面仍存在诸多挑战。近年来,干细胞外泌体在肿瘤治疗领域展现出了巨大的潜力,尤其是在食管癌的治疗中有着独特的意义。
干细胞外泌体,作为一种纳米级的细胞外囊泡,携带着丰富的生物活性分子,包括蛋白质、RNA和其他小分子物质。这些外泌体在细胞间通讯中发挥着重要作用,能够传递生物信息并调节目标细胞的功能。在食管癌的治疗中,干细胞外泌体凭借其独特的优势,正逐渐成为研究热点。
干细胞外泌体在食管癌治疗中的作用机制
抗肿瘤活性
干细胞外泌体中的某些miRNA可以通过调节癌基因和抑癌基因的表达来抑制食管癌细胞的增殖。例如,一些研究发现,外泌体携带的特定miRNA能够靶向抑制食管癌细胞中促进细胞分裂的基因,从而减缓癌细胞的生长速度。
诱导食管癌细胞凋亡是干细胞外泌体发挥抗肿瘤效果的另一个重要途径。它们可以激活癌细胞内部的凋亡信号通路,促使癌细胞发生程序性死亡,进而减少肿瘤细胞的数量。

免疫调节功能
在食管癌患者的免疫系统中,往往存在免疫抑制的情况。干细胞外泌体可以调节免疫细胞的功能,例如增强自然杀伤(NK)细胞、细胞毒性T淋巴细胞(CTL)的活性,使其更好地识别和杀伤食管癌细胞。
外泌体还可以抑制免疫抑制细胞(如调节性T细胞(Tregs)等)的功能,从而解除肿瘤微环境中的免疫抑制状态,为机体免疫系统攻击肿瘤创造有利条件。
靶向药物递送
由于外泌体具有一定的组织和细胞靶向性,可将其作为天然的药物递送载体。将抗癌药物包裹于干细胞外泌体中,通过外泌体与食管癌细胞特异性结合的特性,能够实现药物的精准递送,提高药物在肿瘤部位的聚集浓度,增强抗癌效果的同时减少对正常组织的毒副作用。
试验数据
近期的研究表明,干细胞外泌体在食管癌治疗中展现出显著的效果。新疆医科大学基础医学院进行了相关研究:
将外泌体提取分离,将人脐带间充质干细胞用专用培养基培养,当细胞生长至融合率达 80% 时进行 1∶2 传代培 养。收集 3~4 代的间充质干细胞培养上清液,置于 50 mL 离 心管中,4 ℃、2 000×g 离心 20 min 去除杂质细胞,留取上清 液,0.22 µm过滤筛除去杂质,转移至超离心转子的多聚异体 管中,4 ℃、120 000×g 离心 70 min,弃上清液留取沉淀,用 70 µL PBS重悬沉淀获取外泌体溶液。外泌体蛋白浓度采用 BCA蛋白含量检测试剂盒进行蛋白定量,得到的外泌体溶液置于-80 ℃保存。
食管癌ECA109细胞培养于含10% 小牛血清以及 100 mg /L 青/链霉素的 RPMI1640 培养基中, 37 ℃、5%CO2培养箱内培养,细胞长至对数生长期1∶2传代, 取 3~4 代的细胞用于实验。实验分组:MSC-Exo 组,将外泌 体用 RPMI1640 培养基稀释终浓度为 2×1010/mL,与食管癌 ECA109细胞共培养;空白对照组,用RPMI1640完全培养基 培养食管癌ECA109细胞,每组设置3个复孔。
结果显示
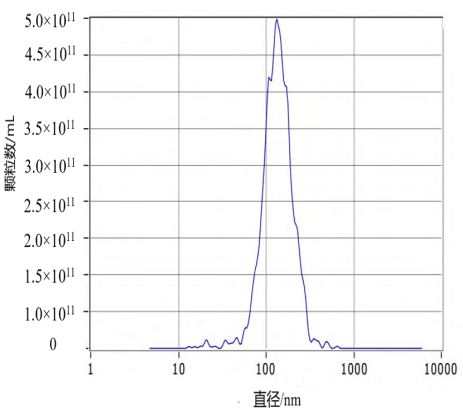
MSC-Exo 鉴定 透射电镜下可见 MSC-Exo 呈 圆盘状,具有双层膜,符合外泌体的形态特征结构。外泌体平均直径峰值(132.8±59.1)nm,浓度为 5.3× 1011Particles/mL。Western blot 实验结果显示 MSCExo表达特异性抗体TSG101、CD63,见图1。
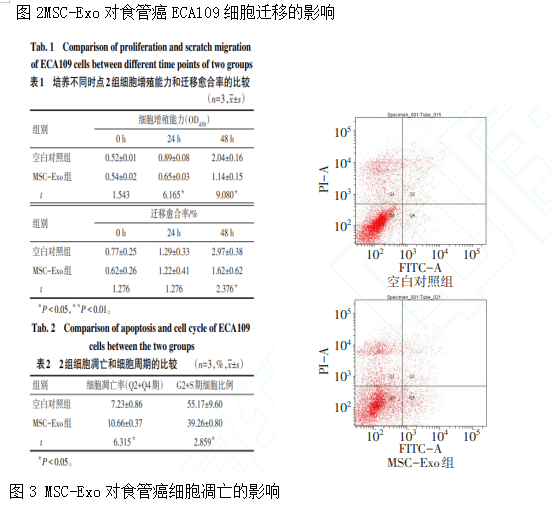
MSC-Exo 对食管癌细胞增殖和迁移能力的影 响 细胞培养0 h时,2组细胞增殖能力和迁移愈合 率差异均无统计学意义(P>0.05);培养 24 h 时, MSC-Exo 组细胞增殖能力低于空白对照组(P< 0.05),迁移愈合率与空白对照组差异无统计学意义 (P>0.05);培养 48 h 时,MSC-Exo 组细胞增殖能力 和迁移愈合率均低于空白对照组(P<0.05),见图 2、表1。
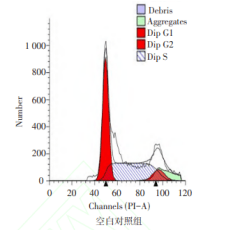
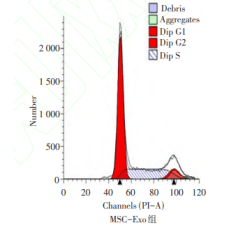
MSC-Exo 对食管癌细胞凋亡和细胞周期的影 响 流式细胞术实验结果显示,MSC-Exo与食管癌 细胞 ECA109 共培养 48 h 后,MSC-Exo 组细胞凋亡 率(Q2+Q4期)高于空白对照组,G2+S期细胞比例低 于空白对照组(P<0.05),见表2,图3、4。2.4 MSC-Exo 对 食 管 癌 细 胞 p-PI3K、p-Akt、β -catenin 蛋白表达的影响 MSC-Exo 组 p-PI3K、pAkt 和 β-catenin 蛋白表达水平均低于空白对照组 (P<0.05),见表3、图5。



MSC-Exo中包含有脂质、蛋白质以及核酸成分,具有亲代细胞的特性和功能,能够模拟亲代细胞体发挥免疫调节、组织修复及抗炎作用。有研究发现,来源于人脐带间充质干细胞的外泌体在体外可抑制胃癌细胞HGC-27的增殖和侵袭,circRNA测序结果提示有效分子可能是外泌体中的circ_ 0027599。但也有研究显示,从MSCs分化的脂肪细胞中分离出的外泌体与乳腺癌细胞MCF7共同培养后,外泌体能够被MCF7细胞吸收摄取,促进肿瘤细胞增殖和迁移。
目前MSC-Exo对肿瘤细胞发 挥抑癌作用或促癌作用具有争议性,分析其原因可能是MSC-Exo本身具有复杂多样性 ,也有可能是由于MSC的培养条件不同等因素引起 MSC-Exo分泌的生物活性因子发生改变,导致其在不同来源或组织环境下的功能和作用不同。不同细胞来源(甚至同源的不同代数)的间充质干细胞所分泌的生物活性因子亦存在差异,这可能是引起功能差异的重要原因之一。
本研究结果显示,MSC-Exo与食管癌细胞ECA109共培养48 h 后,MSC-Exo组p-PI3K、p-Akt 和β-catenin蛋白表达水平均低于空白对照组,提示 MSC-Exo可抑制PI3K、AKT的活化及β-catenin蛋白的表达,与上述研究结果基本一致。提示MSC-Exo 对 PI3K/Akt、Wnt/β-catenin 等信号通路均具有抑制作用,其可通过多条信号通路抑制肿瘤细胞的增殖与迁移。
综上所述,与 MSC相比,MSC-Exo具有低免疫源性、高安全性的治疗优势,且受到道德伦理的限制相对较小。但由于 MSC-Exo的成分和功能因肿瘤类型而异,应用MSC-Exo在不同类型肿瘤患者中的效果需要进行具体分析。这些外泌体能够通过传递特定的microRNA来调节食管癌细胞的增殖、凋亡和迁移等生物学行为。例如,某些microRNA能够下调与食管癌发展密切相关的基因表达,从而抑制肿瘤的生长和扩散。另一方面,干细胞外泌体还具有促进组织修复和再生的能力,有助于恢复食管的正常结构和功能。除了直接作用于肿瘤细胞外,干细胞外泌体还可能通过调节机体免疫反应来增强抗肿瘤效果。外泌体中的某些成分能够激活机体的免疫系统,诱导产生针对肿瘤细胞的特异性免疫反应,从而进一步控制病情的发展。
面临的挑战与未来展望
虽然干细胞外泌体在食管癌治疗中表现出诱人的前景,但仍面临一些挑战。首先,外泌体的大规模生产和质量控制是一个亟待解决的问题。如何产业化生产出质量稳定、活性高的干细胞外泌体是应用于临床治疗的关键前提。其次,外泌体在体内的追踪和作用机制的深入研究还不够全面,需要进一步揭示外泌体与食管癌细胞、免疫细胞以及肿瘤微环境中其他细胞和分子的精细相互作用。
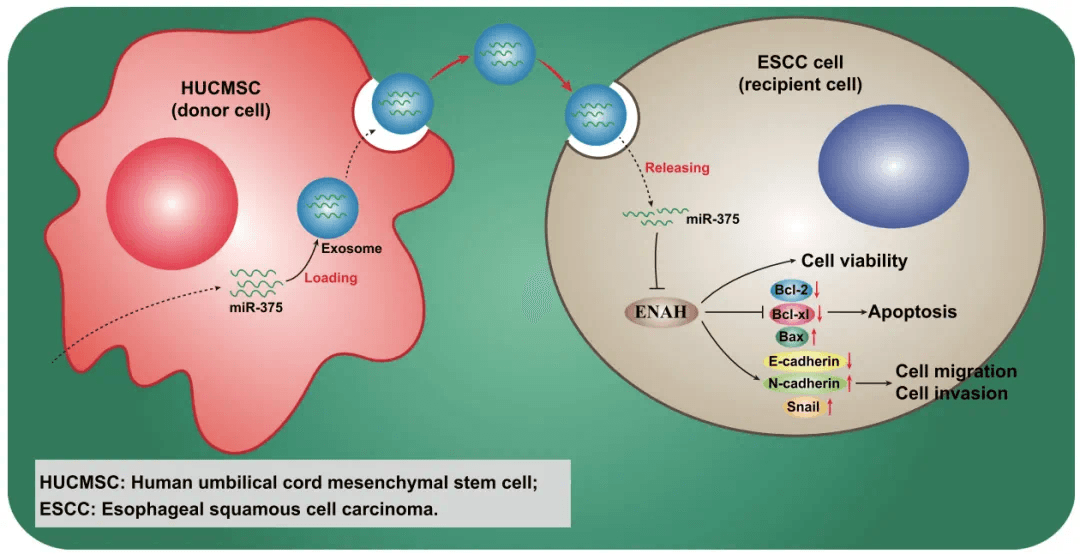
然而,随着生物技术和医学研究的不断深入,未来干细胞外泌体在食管癌治疗中的应用前景仍然十分广阔。有望开发出基于干细胞外泌体的个性化食管癌治疗方案,结合传统治疗方法,为食管癌患者提供更为有效的治疗,改善其生存质量和生存时间。
参考文献
1:VAN GRIENSVEN M,BALMAYOR E R. Extracellularvesicles are key players in mesenchymal stem cells dual potential to regenerate and modulate the immune system[J]. Adv Drug Deliv Rev,2024, 207:115203. doi:10.1016/j.addr.2024.115203.
2:ZHU Y,CHEN X,LIAO Y. Mesenchymal stem cells derived apoptotic extracellular vesicles (ApoEVs) :mechanism and application in tissue regeneration[J].Stem Cells,2023,41(9):837-849. doi:10.1093/stmcls/sxad046.
3: 褚小莉,陈林,朱栋炜. 脐带间充质干细胞来源的外泌体抑制胃 癌细胞的增殖和侵袭[J]. 现代肿瘤医学,32(12):2140-2145. CHU X L,CHEN L,ZHU D W. Exoomes derived from umbilical cord mesenchymal stem cells inhibit proliferation and invasion of gastric cancer cells[J]. Modern Oncolog,2024,32(12)2140-2145.doi10.3969/j.issn.1672-4992.2024.12.002.
4:VAN V S,KOURTI A,AUSLOOS E,et al. ATP13A4 upregulation drives the elevated polyamine transport system in the breast cancer cell line MCF7[J]. Biomolecules,2023,13(6):918. doi:10.3390/ biom13060918. [9] WANG S,SU X,XU M,et al. Exoomes secreted by mesenchymal stromal/stem cell-derived adipocytes promote breast cancer cell growth via activation of Hippo signaling pathway[J]. Stem Cell Res Ther,2019,10(1):117. doi:10.1186/ s13287-019-1220-2.
5:WANG J,ZHANG A,HUANG F,et al. MSC-EXO and tempol ameliorate bronchopulmonary dysplasia in newborn rats by activating HIF-1α[J]. Pediatr Pulmonol,2023 ,58(5):1367- 1379. doi:10.1002/ppul.26317.[11]HU Z,YUAN Y,ZHANG X,et al. Human umbilical:cordmesenchymalstemcell-derivedexosomesattenuateoxygenglucosedeprivation/reperfusion-inducedmicroglial pyroptosis by promoting FOXO3a-dependent mitophagy[J]. Oxid Med Cell Longev,2021,2021:6219715. doi:10.1155/2021/6219715.
6:CAO M,ZHAO Y,CHEN T,et al. Adipose mesenchymal stem cellderived exosomal microRNAs ameliorate polycystic ovary syndrome by protecting against metabolic disturbances[J]. Biomaterials, 2022,288:121739. doi:10.1016/j.biomaterials.2022.121739.
7:QIU Y,SUN J,QIU J,et al. Antitumor activity of cabazitaxel and 102 天津医药 202X 年 X 月第 5X 卷第 X 期 MSC-TRAIL derived extracellular vesicles in drug-resistant oral squamous cell carcinoma[J]. Cancer Manag Res,2020,12:10809- 10820. doi:10.2147/CMAR.S277324. [14]SURAMAN M,KEDRACKA-KROK S,JANKOWSKA U,et al. Proteomic profiling of ectosomes derived from paired urothelial bladder cancer and normal cells reveals the presence of biologically-relevant molecules[J]. Int J Mol Sci,2021,22(13):6816. doi:10.3390/ijms22136816.
8:CHANG W,CERIONE R,ANTONYAK M. Extracellular vesicles and their roles in cancer progression[J]. Methods Mol Biol,2021, 2174:143-170. doi:10.1007/978-1-0716-0759-6_10.
9:LIU J,XIAO Q,XIAO J,et al. Wnt/β-catenin signalling:function, biological mechanisms,and therapeutic opportunities[J]. Signal Transduct Target Ther,2022,7(1):3. doi:10.1038/s41392-021- 00762-6. [17]ZHAO Q,BI Y,ZHONG J,et al. Pristimerin suppresses colorectal cancer through inhibiting inflammatory responses and Wnt/β -catenin signaling[J]. Toxicol Appl Pharmacol,2020,386:114813. doi:10.1016/j.taap.2019.114813.
10:WANG J,HU K,CAI X,et al. Targeting PI3K/AKT signaling for treatment of idiopathic pulmonary fibrosis[J]. Acta Pharm Sin B, 2022,12(1):18-32. doi:10.1016/j.apsb.2021.07.023.
11:QIU L,WANG J,CHEN M,et al. Exoomal microRNA 146a derived from mesenchymal stem cells increases the sensitivity of ovarian cancer cells to docetaxel and taxane via a LAMC2 mediated PI3K/ Akt axis[J]. Int J Mol Med,2020,46(2):609-620. doi:10.3892/ ijmm.2020.4634.
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|Zhang.ZG
审核|Geng.ZG

