
在眼科医学领域,眼部疾病一直是困扰众多患者的难题。从常见的干眼症,到可能导致失明的严重角膜损伤,这些疾病不仅影响患者的视力,更极大地降低了他们的生活质量。不过,随着医学科技的不断进步,干细胞外泌体滴眼液的出现为眼部疾病患者带来了新的希望之光。
传统眼部疾病治疗的困境
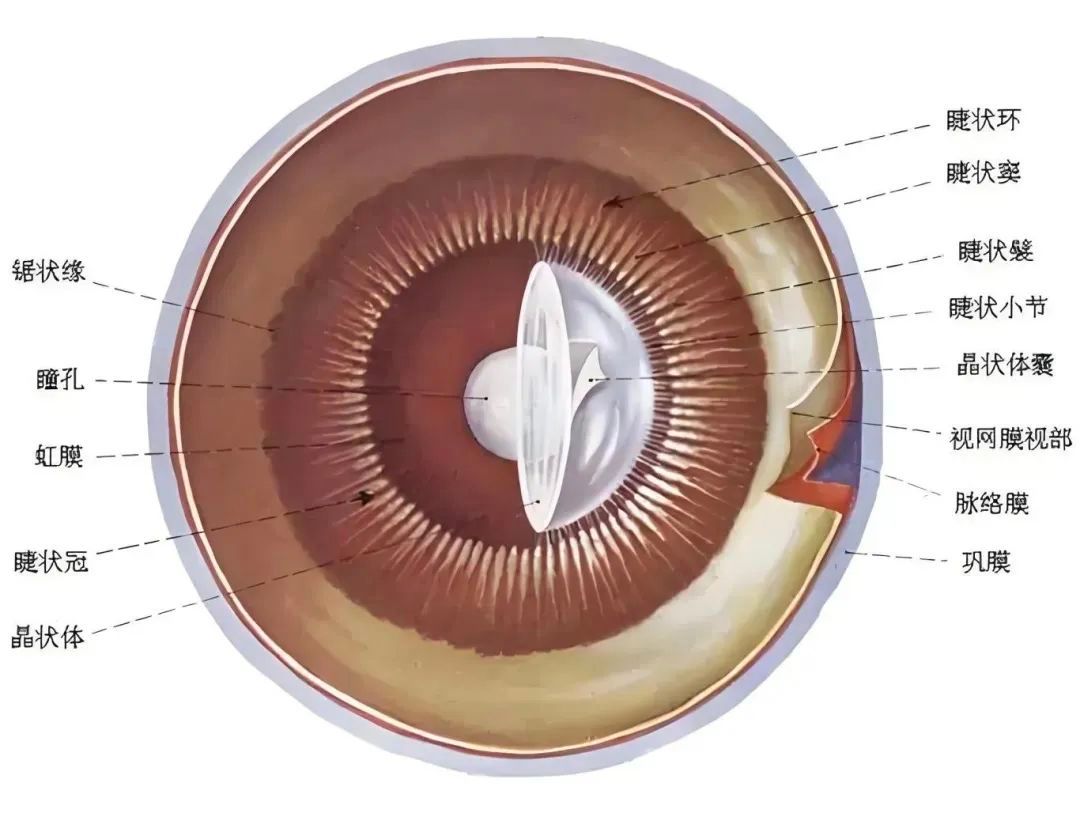
以往,针对眼部疾病的治疗方法较为有限。对于干眼症,常规的治疗手段主要是使用人工泪液来缓解症状,然而这只是治标不治本,无法从根源上解决泪液分泌不足或泪膜不稳定的问题。而对于角膜损伤,轻度损伤可能通过药物促进愈合,但严重的角膜损伤往往需要进行角膜移植手术。角膜移植不仅面临供体角膜稀缺的困境,还存在免疫排斥反应的风险,术后患者需要长期服用免疫抑制剂,这又可能引发一系列其他健康问题。
干细胞滴眼液的神奇作用机制

间充质干细胞(mesenchymal stem cell,MSC)是具有分化、释放再生生长因子和免疫调节等功能且存在于多种组织中的成体干细胞。MSC 在一定条件下可以分化成各种类型的间充质谱系细胞,例如成骨细胞、脂肪细胞和软骨细胞。它们具有增殖和迁移至损伤部位的能力,并通过分泌抗炎和生长因子促进伤口愈合。它们还与先天和后天免疫细胞相互作用,并通过旁分泌作用调节免疫反应。目前普遍认为,MSC 在体内以旁分泌方式起作用,而不是直接分化。
根据细胞中囊泡分泌的方式,细胞外囊泡可分为两大类:一类被称为微囊泡,直接从细胞膜脱落;另一类称为外泌体(exosomes),当多囊体与质膜融合时,通过胞吐作用释放到细胞外环境。外泌体最早是由PAN和JOHNSTONE在1983年发现的 。他们发现在绵羊网状红细胞成熟过程中,转铁蛋白受体释放到细胞外与一种小囊泡有关。1989 年,JOHNSTONE 将这类功能性囊泡定义为外泌体。外泌体是一种细胞外囊泡,直径 40~150 nm,包含特定的蛋白质、脂质、RNA 和 DNA。
1促进组织修复与再生
干细胞外泌体能够携带促生长因子(如VEGF、bFGF等)以及其他对组织再生有益的分子。这些生长因子和分子在眼部组织修复中起到关键作用。当滴眼液中的外泌体被眼部细胞吸收后,它们能够刺激受损细胞的增殖和分化,从而促进角膜、视网膜等组织的修复和再生。这一机制在视网膜退行性变、角膜损伤等眼科疾病的治疗中尤为重要。
2抗炎作用
干细胞外泌体具有显著的抗炎作用。它们能够调节眼部免疫微环境,减少炎症反应。在干眼症、角膜炎等由免疫引起的眼科疾病中,外泌体能够抑制炎症细胞的浸润和活性,减轻炎症症状,并促进局部免疫环境的恢复。这一机制有助于缓解眼部不适,提高患者的生活质量。
3减少纤维化与疤痕形成
眼部手术后常常会出现纤维化和疤痕形成,这不仅影响术后效果,还可能导致视力进一步下降。干细胞外泌体能够通过抑制成纤维细胞的活性,减少纤维化和疤痕的形成。这一机制有助于促进更为理想的愈合过程,提高手术成功率。
4精准靶向递送
干细胞外泌体具备较高的靶向性,能够精准地将治疗分子送至病变部位。这一特性使得滴眼液中的外泌体能够直接作用于受损的眼部细胞,提高治疗效果的同时减少副作用。结合基因编辑技术和纳米技术,外泌体的靶向递送系统能够进一步提高疗效。
外泌体治疗眼科疾病盘点
干细胞滴眼液在临床应用中已经取得了令人瞩目的成果。在治疗干眼症方面,多项临床试验表明,使用干细胞滴眼液的患者泪液分泌量明显增加,泪膜破裂时间延长,眼部干涩、异物感等症状得到显著改善。许多患者不再依赖频繁使用人工泪液,生活质量得到了大幅提升。
1干细胞移植在视神经损伤中的应用
干细胞移植在大鼠中治疗视神经损伤显示出有希望的结果,通过促进轴突再生和改善视觉功能。然而,需要更多的研究来了解其在人类中的全部潜力。在视神经压碎的大鼠模型中,移植人类脐带Wharton's jelly衍生的MSCs及其细胞外囊泡,促进视网膜神经节细胞(RGCs)的存活和再生。MSCs对RGCs有持续的神经保护作用,可在受伤后长达120天,促进轴突再生和视觉目标的再神经支配。使用基因疗法抑制Nogo受体(NgR)在生长敏感的RGCs中,以及中枢神经系统(CNS)中的轴突再生可以增强,但前提是激活神经元的内在生长程序。另一方面,野生型NgR的过度表达,阻断了生长敏感的RGCs的再生,并导致轴突回缩。干细胞疗法可以替换受损的视网膜神经节细胞,提供营养因子,供应健康的线粒体,并发挥神经保护作用,以介导RGCs的内源性再生。
2干细胞外泌体在视网膜退行性
病变的应用
外泌体滴眼液能够通过促进受损细胞的增殖和再生,帮助修复受损的视网膜组织。其含有的生长因子和其他有益分子,为视网膜细胞提供了必要的营养和支持,有助于恢复视力功能。
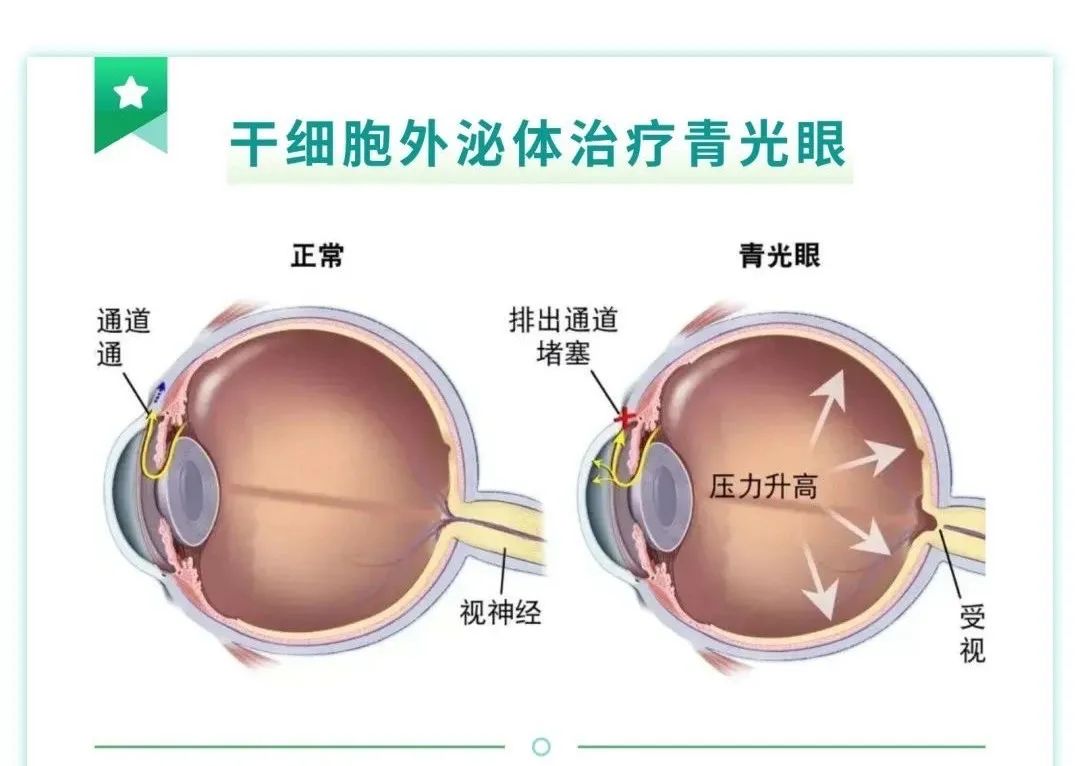
3干细胞外泌体在青光眼的应用
对于青光眼这样的视神经退行性疾病,外泌体滴眼液则展现出降低眼内压、保护视神经的作用。通过减轻炎症反应和减少纤维化,外泌体有助于缓解青光眼病情,防止视力进一步下降。
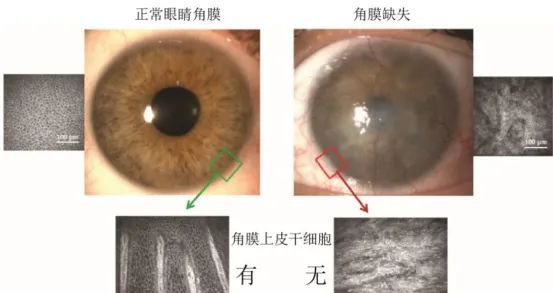
4干细胞外泌体在角膜损伤的应用
对于角膜损伤患者,干细胞滴眼液同样表现出色。一些因化学伤、热烧伤等导致角膜严重受损的患者,在使用干细胞滴眼液治疗后,角膜的透明度得到恢复,视力也有了不同程度的提高。部分原本面临角膜移植风险的患者,通过干细胞滴眼液的治疗,避免了手术,减少了后续可能出现的并发症。
5干细胞外泌体在干眼症的应用
中山大学柳夏林教授的团队在《Science Advances》发表文章,报道了间充质基质细胞外泌体(MSC exo)作为滴眼剂,可通过抑制炎症和促进上皮恢复,明显缓解移植物抗宿主病(GVHD)相关的干眼病有14例患有难治性移植物抗宿主病(GVHD)相关干眼症的患者,他们总共的28只眼睛对诸如外用类固醇、人工泪液,甚至是自体血清等治疗手段均无反应。然而,在接受了干细胞外泌体的治疗之后,这些眼睛都表现出了实质性的缓解情况。具体体现为:荧光素评分有所降低,泪膜破裂时间得到延长,泪液分泌量出现增加,眼表疾病指数(OSDI)评分也降低了。从机制上讲, MSC-exo 通过miR-204 介导的IL-6/ IL-6R/STAT3 通路靶向, 将促炎的M1 巨噬细胞重新编程为免疫抑制的M2。具体内容如下:
1.在干眼症患者中, 干细胞外泌体能缓解⻆膜损伤。研究入组了14 例(28 只眼睛) 往期对类固醇、 人工泪液等常规治疗手段无效的干眼症患者。 利用外泌体每天滴4 次, 连续用2周。外泌体用了2 周后, 角膜损伤明显减轻, 上皮恢复改善。 泪膜破裂时间延长、 泪液分泌增多、 眼表疾病指数 (OSDI) 评分更低。干眼症状相关的刺痛、 灼烧、 结痂或发红在MSC- exo 治疗后得到缓解。未观察到对眼压的明显影响, 未见与MSC-exo 相关的并发症。部分患者在干眼症状缓解后可减少原药的使用。干眼症状的显著缓解改善了生活质量。这些观察表明MSC-exo 滴眼液治疗GVHD相关严重干眼患者的一种安全、 无创、 有效的无细胞治疗。
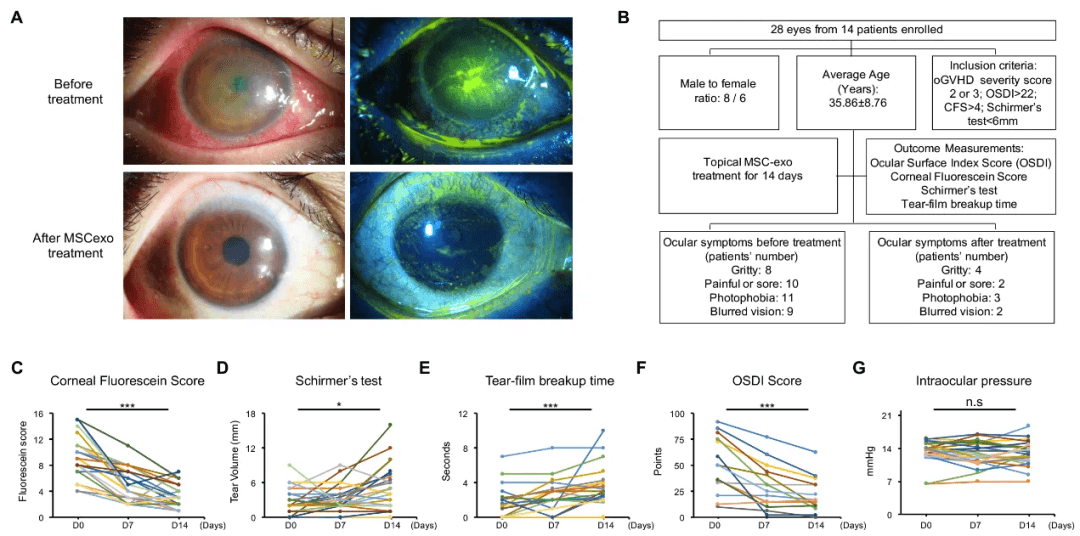
干细胞外泌体用于临床干眼症患者的效果。 A-角膜荧光染色, 外泌体滴眼后明显改善。 B-临床入排标准和随访内容。 C-角膜荧光染色得分 (越小越好)。 D-泪液分泌量测试(越多越好)。 E-泪膜破裂时间 (越大越好)。F-眼表疾病指数(越低越好)。 G-眼压(10-20 为正常水平)。
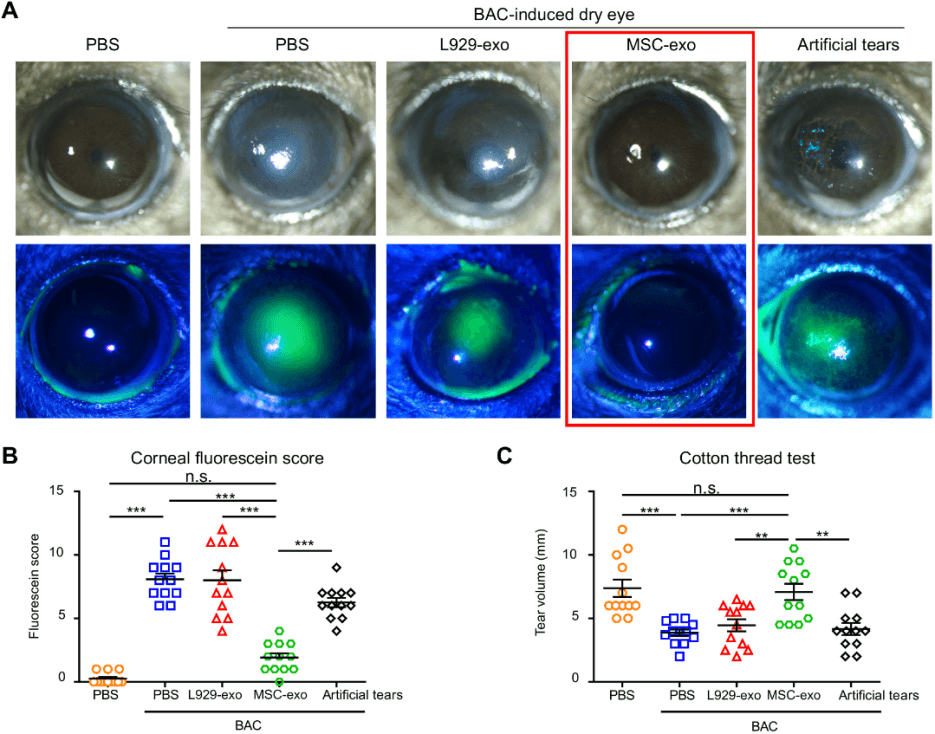
2.干细胞外泌体可以缓解模型的干眼症状。在苯扎氯铵BAC 诱导的小鼠模型中, 只有干细胞外泌体MSC-exo 组可以缓解模型的干眼症状, 包括角膜荧光染色 (下图A和B, 正常值: 角膜应无或仅有轻微点状染色; 异常值: 广泛的点状、 线状或片状染色可能表示角膜上皮受损)、 棉线测试看泪液分泌(下图C)。像成纤维细胞来源的外泌体 (L929-exo) 或人工泪液都无法达到缓解效果。
6干细胞外泌体在自身免疫性葡萄
膜炎的应用
葡萄膜炎是累及葡萄膜、视网膜、视网膜血管及玻璃体的一组炎症性眼病。在其他器官组织上已经证明外泌体参与了炎症性和自身免疫性疾病的发展和治疗。目前,干细胞外泌体疗法正在被探索作为葡萄膜炎的潜在治疗方法。结果表明,间充质干细胞外泌体通过抑制炎症细胞的迁移有效地改善了葡萄膜炎,表明间充质干细胞外泌体对葡萄膜炎有望成为潜在的新疗法。
外泌体滴眼液的优势在于其精准靶向递送能力和较高的生物相容性。这使得药物能够直接作用于病变部位,提高治疗效果的同时减少副作用。此外,外泌体作为天然的细胞间通讯媒介,能够更好地与人体细胞相互作用,促进组织修复和再生。
未来展望
干细胞滴眼液的出现,无疑是眼部疾病治疗领域的一次重大突破。它为众多眼部疾病患者提供了一种安全、有效的治疗新选择,也为眼科医学的发展开辟了新的道路。MSC-Exos 已经在眼部疾病中显示出巨大的应用潜力,首先,MSC-Exos 能够抑制角膜炎症,促进角膜伤口愈合等作用;其次,无论在激光刺激的视网膜损伤还是高糖诱导的视网膜损伤中,MSC-Exos 都可以缓解其损伤或炎症程度,对于难治性黄斑裂孔的术后恢复也有很大的帮助;最后,MSC-Exos 还可以在青光眼中促进神经保护。虽然 MSC-Exos 在眼部疾病中已经取得一定的成果,但是仍然存在着许多未知和挑战。有挑战就有希望,外泌体有望成为治疗眼部疾病的新策略,从而为眼部疾病患者带来新的希望。
参考文献
1:王文晟,孔冰洁,唐超智等 . 骨关节炎间充质干细胞治疗进展[J]. 河南师范大学学报(自然科学版),2019,47(6):82-88.DOI:10. 16366/ j. cnki. 1000-2367. 2019. 06. 013.
2:DENG H,SUN C,SUN Y,et al. Lipid,Protein,and MicroR‐·2297中国免疫学杂志 2021 年第 37 卷NA composition within mesenchymal stem cell-derived,exosomes[J]. Cell Reprogram,2018,20(3):178-186. DOI:10. 1089/cell. 2017. 0047.
3:PHINNEY D G,PITTENGER M F. Concise review:MSC-de‐rived exosomes for cell-free therapy[J]. Stem Cells,2017,35(4):851-858. DOI:10. 1002/ stem. 2575.
4:HARRELL C R,JOVICIC N. Therapeutic use of mesenchymalstem cell-derived exosomes:From basic science to clinics[J].Pharmaceutics,2020,12(5):474. DOI:10. 3390/ pharmaceutics12050474.
5:HARRELL C R,MILORADOVIC D,SADIKOT R,et al. Molec‐ular and cellular mechanisms responsible for beneficial effects ofmesenchymal stem cell-derived product "Exo-d-MAPPS" in atten‐uation of chronic airway inflammation[J]. Anal Cell Pathol(Amst),2020,2020:3153891. DOI:10. 1155/ 2020/ 3153891.
6:MACHAIRAKI V. Human pluripotent stem cells as in vitro mod‐els of neurodegenerative diseases[J]. Adv Exp Med Biol,2020,1195:93-94. DOI:10. 1007/ 978-3-030-32633-3_13.
7:PAN B T,JOHNSTONE R M. Fate of the transferrin receptorduring maturation of sheep reticulocytes in vitro:selective exter‐nalization of the receptor[J]. Cell,1983,33(3):967-978. DOI:10. 1016/ 0092-8674(83)90040-5.
8:JOHNSTONE R M,BIANCHINI A,TENG K. Reticulocytematuration and exosome release:Transferrin receptor containingexosomes shows multiple plasma membrane functions[J]. Blood,1989,74(5):1844-1851. DOI:10. 1182/ blood. v74. 5. 1844. 1844.[13] MA Z J,WANG Y H,LI Z G,et al. Immunosuppressive effect
of exosomes from mesenchymal stromal cells in defined mediumon experimental colitis[J]. Int J Stem Cells,2019,30:12(3):440-448. DOI:10. 15283/ ijsc18139.
9:miR-204–containing exosomes ameliorate GVHD-associated dry eye disease
免责声明:本文旨在科普相关知识、不作为医疗指导意见
编辑|Zhang.ZG
审核|Geng.ZG

