
细胞疗法为复发难治性疾病带来新机遇,其中间充质干细胞(MSC)疗法应用广泛。MSC 临床转化已近 30 年,但其生物学特性等仍在探索。MSC 疗法产品临床使用有药品监管和医疗技术两条路径。美国FDA将其按研究型新药申报;欧洲EMA集中监管但有成员国医疗机构豁免政策;日本实行“双轨制”监管;我国临床试验阶段有两条路径,上市需经国家药监局审评审批。目前,获批上市的MSC疗法产品较少。
1 间充质干细胞的特性及其作用机制
间充质干细胞(MSC)来源于中胚层,具有自我更新和多向分化能力,可分化为骨、脂肪、软骨等多种细胞类型。MSC广泛存在于不同组织,如骨髓、脐带、胎盘和脂肪等,但其原生身份、组织分布和自然功能仍未确定。MSC的鉴定标准包括特定细胞表面标志、成骨、成脂肪、成软骨的多向分化潜能等。其作用机制涉及迁移、分化潜能、旁分泌以及与微环境的相互作用,但其具体体内机制仍需进一步研究。
2 国内外间充质干细胞疗法产品申报现状
MSC疗法产品在我国申报量最大,已获批70余项临床试验。研发和申报的MSC疗法产品主要来源于脐带、脂肪、骨髓、胎盘等成体组织,也包括经基因修饰的MSC和由诱导性多能干细胞分化来的MSC。尽管申报类型多样,但整体发展呈现小、散、乱的局面,且大量临床研究未进入关键临床阶段。目前,仅有一家MSC产品在免疫和炎症疾病疗法领域接近上市申请。
国际范围内,截至目前仅有12种MSC产品获得监管机构批准并进行商业化(表1),其中已上市产品中有9种MSC产品来自亚洲,韩国是获得批准MSC疗法产品最多的国家。
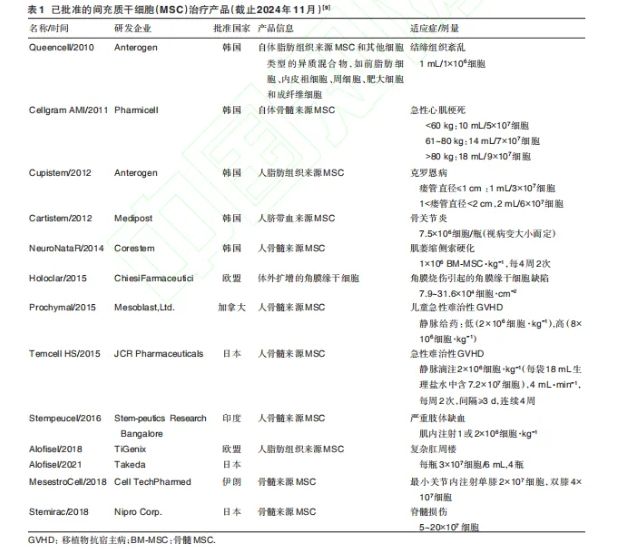
部分MSC疗法产品已在先进监管国家或地区获得批准或争取上市,如2015年日本批准的Temcel疗法用于移植物抗宿主病(GVHD),2018年批准的Stemirac疗法用于脊髓损伤,2018年EMA批准的Alofise疗法用于克罗恩病患者的复杂肛周瘘。美国FDA多次审评Remestemcel-L疗法用于难治性急性GVHD儿童患者。Remestemcel-L最初由美国Osiris公司研制并在加拿大、新西兰和日本上市,但在美国FDA的申报遭遇阻碍,原因可能是现阶段标准对早期批准的MSC疗法产品进行安全性、有效性和质量可控性重新评估时存在不确定性,且经济因素可能导致部分产品未及时更新许可证,面临退市风险。
3 间充质干细胞疗法产品的成药性挑战
3.1 药学研究
间充质干细胞疗法产品体外药学(CMC)研究呈现异质性高的特点,这可能制约其安全性和有效性,尤其是来源的异质性、个性化独特工艺和质量表征等方面。有效克服 MSC疗法产品异质性的影响,确保产品的批间一致性至关重要。
3.1.1 供体和组织异质性
MSC疗法产品的疗效受供体来源差异的影响,表现为生物学特性和功能的显著差异。老年供体的MSC衰老特征明显,分化潜力较低,且男性和女性供体的MSC在增殖、基因表达及免疫调节等方面存在差异。个体差异和供体健康状态也会显著影响MSC的增殖和免疫调节能力,需在自体疗法中予以考虑。MSC来源多样,不同组织来源的MSC在分化潜能、增殖率、免疫调节特性等方面也存在差异。例如,脐带来源MSC增殖能力最强,但分离成功率较低,脂肪来源MSC对树突状细胞的调控能力较强。由于MSC来源差异性大,产品开发中需减少影响批间一致性的变量,确保质量稳定,并加强对不同来源细胞的研究,逐步拓宽产品来源边界,保证产品质量及其延续性。
3.12 工艺差异和变更
MSC疗法产品的生产工艺和工艺变更复杂多样,给质量一致性和成药性带来很大挑战。由于不同的分离和培养方法、培养基成分、外界因素等的差异,MSC产品的细胞特性和异质性也存在很大变化。因此,必须基于质量源于设计的理念,深入研究生产工艺与产品质量之间的关系,关注MSC在体外分离、扩增过程中的形态、活力、基因组稳定性等因素,逐步建立标准化流程,并按照cGMP规范进行生产,以确保产品质量一致性并为临床研究提供高质量样品。
3.1.3 质量研究和活性测定
MSC(间充质干细胞)疗法产品在质量控制和临床有效性评估方面面临重大挑战,尤其是在质量标准的设定、产品鉴定、活性表征及其免疫调节功能等方面。鉴于MSC疗法的高度复杂性和细胞异质性,传统的分析方法有局限性,需要开发先进的分析工具如单细胞测序,来更准确地评估细胞群体的组成和活性。加强对MSC产品的全面质量研究,并从“以患者为中心”的角度,通过细致的活性测定和免疫调节特性的研究,建立更加科学和规范的质量控制策略,是推进MSC疗法临床应用的关键。
3.2 非临床研究
非临床研究通过提供安全性和有效性证据,支持产品的临床应用。药理学研究揭示作用机制和生物学合理性,药动学研究评估MSC产品在体内的命运和行为,非临床安全性研究评估各类毒性及安全性。MSC疗法产品面临动物模型难以模拟人类疾病、结果可重复性差等挑战,需要通过体外和体内模型的完善、探索适合的动物模型来克服这些问题,确保研究的有效性和临床应用的安全性。
3.3临床研究
MSC疗法在临床研究中主要关注安全性,尚缺乏明确的有效性结论。不同给药途径、给药时间等因素可能显著影响治疗效果,特别是在特定适应症下,选择合适的治疗方案尤为重要。目前临床研究趋向规范化,但由于适应症、病理基础、剂量、给药途径等因素的复杂性,且临床试验样本量较小,药物开发面临一定的挑战。为了满足患者需求,需加强研究者与监管机构的沟通,推动临床研究进展。
4 结语
安全性、有效性和质量可控性是药品的三大基本属性,MSC疗法产品在成药过程中面临来源和工艺异质性等挑战,尤其是质量表征和活性测定等CMC问题,增加了不确定性。优先加强CMC质量工作,建立科学规范的质量标准和控制体系,有助于提高临床有效性,并推动MSC疗法产品的进一步发展。
参考文献
[1] 韩冬梅,周菂,张毅,等.间充质干细胞治疗产品申报进展及成药性挑战[J/OL].中国药理学与毒理学杂志,1-7[2025-01-20].http://portal.sclib.cn/interlibSSO/goto/11/+jmr9bmjh9mds/kcms/detail/11.1155.R.20250109.1612.002.html.
[2] Ghoneim MA, Refaie AF, Elbassiouny BL, et alFrom mesenchymal stromal/stem cells to insulin.producing cells: prgress and challenges[J]. StemCeN Rev Rep, 2020,16(6):1156-1172.
[3] 卢加琪,刘丹,寇雅真,等.我国先进疗法药品的范围及分类研究和建议.中国食品药品监管(ChinaFood Drug Administration), 2024(5):10-25.
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|LiYe.ZG
审核|Geng.ZG

