
TIL疗法(肿瘤浸润淋巴细胞疗法)是一种新型的过继性细胞免疫治疗方法,通过从患者肿瘤组织中分离出具有抗肿瘤活性的肿瘤浸润淋巴细胞(TIL),在体外进行扩增和激活后,再回输到患者体内,从而增强患者自身的免疫系统对肿瘤细胞的识别和攻击能力。TIL疗法是最早开发且首个获美国FDA批准用于实体瘤治疗的ACT疗法,这种疗法利用了TIL细胞的肿瘤归巢特性和多克隆性,能够精准靶向多种肿瘤抗原,尤其在实体瘤治疗中展现出良好的疗效和较低的副作用。
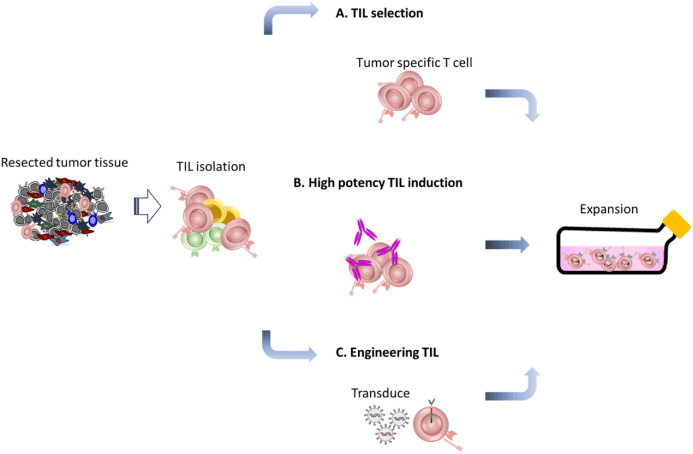
TIL生产的示意图概述。TILs是从新鲜切除的肿瘤组织中分离出来并生长的。根据表达标志物选择肿瘤反应细胞,例如CD39+/CD103+,PD-1,CD39-/CD69-和4-1BB;B肿瘤组织在抗体存在下培养,例如4-1BB和OX40,TIL上的C基因修饰以增强TIL功能。
与之相比,CAR-T和TCR-T是另外两种基于肿瘤特异性T细胞的ACT形式。CAR-T依赖对患者外周血T细胞基因改造,通过抗原-抗体识别消除靶细胞,对血液系统恶性肿瘤中特定表面抗原(如CD19)有效,但因实体瘤抗原复杂、高肿瘤负荷需大量免疫细胞而增加“靶向、非肿瘤(OTOT)”毒性风险,且体内快速扩增和靶细胞杀伤可能引发细胞因子释放综合征(CRS),限制了其在实体瘤治疗中的应用。TCR-T细胞经基因工程改造表达靶向MHC分子上呈递的细胞内抗原的特异性TCR,能攻击更广泛肿瘤特异性抗原,在实体瘤治疗中有潜力,但同样面临CRS和OTOT毒性以及交叉反应性等挑战。
而TIL疗法在治疗实体瘤方面优势显著,其由多种识别多种肿瘤抗原的T细胞克隆组成,可解决实体瘤异质性问题,许多TIL靶向新抗原,降低脱靶毒性风险,且未报道OTOT或CRS毒性。此外,TIL直接来源于肿瘤组织,天然具有浸润肿瘤能力,其多由表达特定趋化因子受体的效应记忆T细胞组成,增强了穿透实体瘤的能力,是实体恶性肿瘤(包括肺癌)颇具前景的治疗选择。
案例分享

这篇文章探讨了肿瘤浸润淋巴细胞(TIL)治疗在转移性黑色素瘤中的应用,重点关注其增强新抗原特异性T细胞反应性以及长期随访结果。研究在荷兰癌症研究所进行,纳入10名转移性黑色素瘤患者,其中5名患者(包括2名完全缓解者)表现出客观临床反应,部分患者的完全缓解持续超过7年。研究发现,TIL治疗能够显著增强新抗原特异性T细胞的反应性,这些T细胞在治疗后外周血中的频率显著增加,并可长期存在(长达3年)。此外,研究结果支持开展多中心III期临床试验,以进一步评估TIL治疗在转移性黑色素瘤中的应用价值。
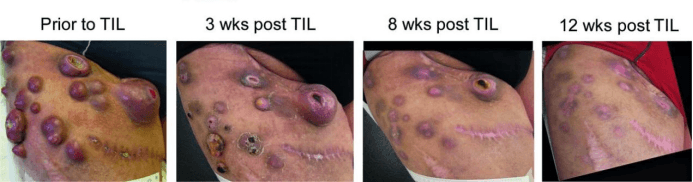
这是一例复发性宫颈癌伴多处转移的患者接受自体肿瘤浸润淋巴细胞(TIL)治疗(GT101)联合IL-2注射的临床研究。研究中,患者在经过改良的淋巴清除方案后接受了TIL治疗,随后表现出部分缓解(PR),且免疫相关不良事件(irAE)可耐受。治疗后,外周血中T细胞受体(TCR)克隆显著扩增并长期存在,表明TIL成功植入并发挥抗肿瘤作用。研究还发现,TIL产品中富含中央记忆型T细胞表型(CD45RO⁺CD62L⁺),且CD8⁺T细胞中存在较高比例的干细胞样亚群(CD39⁻CD69⁻CD8⁺),可能与其临床疗效相关。此外,通过TCR库分析发现,治疗后外周血中与新抗原相关的TCR克隆比例增加,提示其可能靶向肿瘤相关抗原。该研究支持从转移性淋巴结中获取TIL用于治疗难治性宫颈癌的潜力。
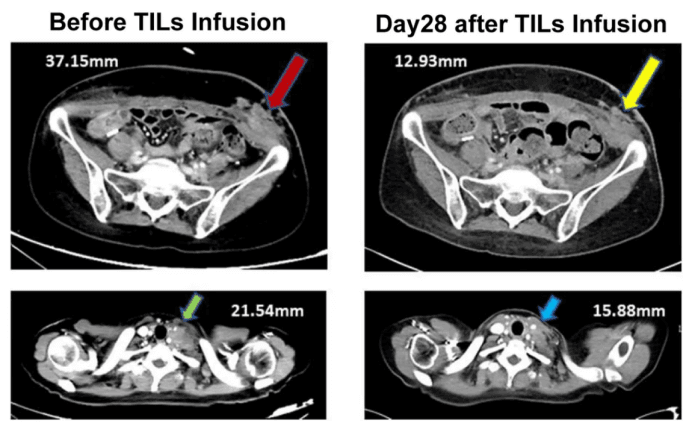
计算机断层扫描显示,在以IL-2作为辅助治疗的TILs治疗前,基线时左下腹部(左上图,红色箭头)和左侧锁骨上淋巴结(左下图,绿色箭头)皮下转移。2022年1月10日(TILs输注后28天)获得的计算机断层扫描显示(右上图,黄色箭头)的锁骨上淋巴结收缩与左侧左下腹部皮下转移(右下图,蓝色箭头)重合。

这是一项关于晚期黑色素瘤(MEL)患者接受肿瘤浸润淋巴细胞(TIL)治疗的分析。回顾了2009至2018年在莫菲特癌症中心进行的4项1/2期临床试验数据,涉及60名患者,分别接受单独TIL治疗或联合伊匹木单抗(ipi)、纳武利尤单抗(nivo)或维莫非尼(vem)治疗。结果显示,在意向治疗(ITT)人群中,中位无进展生存期(PFS)为7个月,总生存期(OS)为31个月;而在实际接受TIL治疗(TT)的患者中,中位PFS为10个月,中位OS为52个月。客观缓解率(ORR)为36%,完全缓解率为14%。研究发现,输注的TIL总数增加和输注产品中CD8⁺细胞比例较高与更好的治疗效果相关,而乳酸脱氢酶(LDH)水平、既往治疗和IL-2剂量与疗效无关。此外,肝转移患者倾向于无反应(p=0.05),且在TIL治疗进展后接受免疫检查点抑制剂(ICB)治疗的患者中,反应率为19%。总体而言,TIL治疗在晚期黑色素瘤患者中显示出较好的疗效,尤其是当输注的TIL数量较多且以CD8⁺细胞为主。
小结
在临床试验中,TIL疗法已展现出对黑色素瘤、宫颈癌、肺癌等多种癌症的良好疗效。然而,TIL疗法的推广仍面临诸多挑战,包括复杂的治疗流程、高昂的成本、潜在的副作用以及技术普及的难度。尽管如此,随着基因工程技术的进步和临床研究的深入,TIL疗法的疗效和安全性正在不断提升。例如,通过基因编辑技术改造TIL细胞,可以增强其抗肿瘤能力并减少副作用。此外,国内企业在TIL疗法的研发上也取得了显著进展,有望进一步推动其临床应用。
总体而言,TIL疗法的发展为癌症治疗开辟了新的道路,其在多种实体瘤中的应用前景广阔。随着技术的不断完善和临床研究的持续推进,TIL疗法有望成为未来癌症治疗的重要手段,为更多患者带来长期生存的希望。
参考文献
[1]Zhao X,et al.T cell receptor repertoire characteristics and therapeutic potential of tumor infiltrating lymphocytes (TILs) derived from metastatic lymph node in cervical cancer. Mol Biomed. 2024 Nov 4;5(1):51.
[2]Karapetyan L,et al.450 Pooled analysis of efficacy outcomes from early-phase trials of tumor infiltrating lymphocyte therapy in advanced melanoma[J]. 2024.
[3]van den Berg J H,et al.Tumor infiltrating lymphocytes (TIL) therapy in metastatic melanoma: boosting of neoantigen-specific T cell reactivity and long-term follow-up[J]. Journal for immunotherapy of cancer, 2020, 8(2).
[4] Matsueda S, Chen L, Li H, Yao H, Yu F. Recent clinical researches and technological development in TIL therapy. Cancer Immunol Immunother. 2024 Sep 12;73(11):232.
编辑|Yuanyuan.ZG
审核|Geng.ZG

