
2024年是免疫细胞治疗领域取得重大进展的一年,从基础研究到临床应用,再到产业化发展,均呈现出蓬勃发展的态势。据统计,2024年我国IND合计85项,免疫细胞药物IND年获批的不到60项。目前免疫细胞最主要的适应症还是血液系统肿瘤(主要以CAR-T、CAR-NK为主);实体瘤的批件目前已经逐渐接近血液系统肿瘤(主要是TCR-T、TIL以及CTL等)。今天我们一起从技术进展、临床转化、产业化发展以及未来展望四个方面,对2024年免疫细胞治疗的进展进行总结。
技术层面
2024年,免疫细胞治疗技术在多个方面取得了显著进展,主要包括CAR-T细胞治疗、CAR-NK细胞治疗、TCR-T细胞治疗和TIL细胞治疗等。
CAR-T疗法

CAR-NK疗法

TIL疗法

TCR-T疗法

临床转化
随着技术的日益成熟,免疫细胞治疗产品的临床及转化应用进程不断加速。据Cortellis数据库统计,截至2024年底,已有1040件免疫细胞治疗产品迈入临床试验阶段,其中CAR-T细胞治疗产品达621件,占比59.7%。
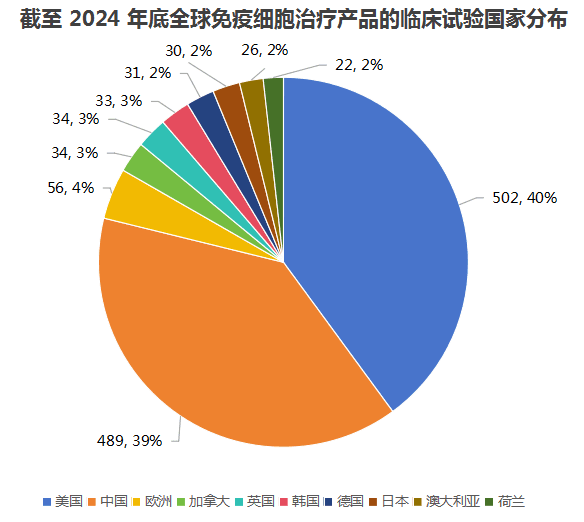
1、中美两国为全球临床试验最为活跃的区域
美国开展临床试验的免疫细胞治疗产品502个,全球占比48.3%,位居首位;我国开展临床试验的免疫细胞治疗产品489个,全球占比47.0%,位居第二位。
2、临床阶段主要集中于临床I期和II期
临床I期:560个,临床II期:395个,临床III期:20个。CAR-T细胞治疗产品仍是进入临床阶段最多的免疫细胞类型,总数约占进入临床阶段的免疫细胞治疗产品2/3。
3、美国机构领跑免疫细胞产品研发与创新
主要机构:国家癌症研究所(NCI)、贝勒医学院、M.D.安德森癌症中心、宾夕法尼亚大学、斯隆—凯特林癌症研究所、Kite Pharma Inc和百时美施贵宝。
中国机构:深圳基因免疫医学研究所、浙江大学和AbelZeta Inc(原西比曼)。
4、新型免疫细胞疗法进入临床转化阶段
CAR-NK细胞疗法:2024年1月,美国MD安德森癌症中心报告了CAR-NK细胞疗法在CD19阳性B细胞恶性肿瘤患者中的1/2期临床试验数据,结果发现CAR-NK细胞在CD19阳性恶性肿瘤患者中具有优异的抗肿瘤活性。
TCR-T细胞疗法:2024年9月,美国国家卫生研究院开展了一项TCR-T治疗转移性结直肠癌的II期临床试验,结果发现7例患者中有3例患者效果明显,转移性肿瘤消退,并持续4-7个月。
自身免疫性疾病治疗:2024年2月,德国埃尔兰根大学医院采用了CAR-T细胞治疗15例自身免疫性疾病患者,结果显示在停止包括糖皮质激素在内的免疫抑制和抗炎药物的情况下,所有患者的临床症状都明显得到缓解。
产业化发展
2024年,免疫细胞治疗产业进入高速发展阶段,TCR-T、TIL等多种新型细胞治疗药物的陆续上市,临床与上市的监管程序持续完善。
多款免疫细胞治疗产品上市
Aucatzyl:2024年11月,美国FDA批准了Autolus Therapeutics针对CD19的CAR-T细胞治疗药物Aucatzyl,用于治疗复发或难治性前体B细胞急性淋巴细胞白血病的成年患者。Afami-cel:2024年8月,Adaptimmune Therapeutics宣布其TCR-T细胞治疗产品Afami-cel获FDA批准上市,用于晚期滑膜肉瘤的治疗。Lifileucel:2024年2月,Iovance Biotherapeutics宣布其TIL细胞治疗产品Lifileucel获得FDA批准上市,用于治疗PD-1抗体治疗后进展的晚期黑色素瘤。泽沃基奥仑赛:2024年3月1日,科济药业宣布其CAR-T细胞治疗产品泽沃基奥仑赛注射液获国家药品监督管理局批准上市,用于治疗复发或难治性多发性骨髓瘤。
政策推动免疫细胞治疗产业健康发展
国际范围内
2024年1月,美国FDA发布《应用人基因组编辑技术的人类基因治疗产品行业指南》,包括产品设计、产品测试、产品制造、非临床安全性评估和临床试验设计等内容,为企业评估基因治疗产品的质量与安全性提供建议。2024年1月,美国FDA发布了《CAR-T细胞产品开发的注意事项产业指南》,为CAR-T细胞产品的开发提供了化学、制造和控制(CMC)、药理学和毒理学以及肿瘤适应症临床研究设计的相关建议。2024年4月,美国FDA发布了《扩展用于细胞治疗产品的人同种异体细胞的安全性测试》,提出细胞安全测试应基于风险分析,考虑细胞的扩增潜力,用于扩增培养中细胞的试剂以及基于细胞的医疗产品能够治疗的个体数量。
国内方面
2024年9月,国家卫生健康委员会、国家中医药局和国家疾控局三部委联合发布了《医疗卫生机构开展研究者发起的临床研究管理办法》,有序推动了细胞治疗等前沿技术领域研究者发起的临床研究的开展。2024年11月,国家药品监督管理局发布《细胞治疗产品临床药理学研究技术指导原则(试行)》,阐述了细胞治疗产品临床药理学研究的关键技术、研究内容及评价标准。
全球投资情况
新型免疫细胞疗法成为投融资重点关注领域,2024年上半年,全球细胞和基因治疗(CGT)行业的投资额达到了109亿美元(约777亿人民币)。尽管受到资本寒冬等影响,高价值的企业与产品仍受到市场的青睐。
未来展望
免疫细胞疗法作为一种革命性的治疗手段,已经显著改变了癌症治疗的格局。当前,2024年针对CD19和BCMA靶点的CAR-T疗法同质化趋势明显,导致同类产品的市场利润空间逐渐缩小。尽管最成熟的CAR-T细胞疗法已进入产业化阶段,主要用于治疗血液肿瘤,且针对复发或难治性癌症患者,但其应用仍然存在显著局限。因此,研发新型替代性免疫细胞疗法变得愈加重要,特别是在临床转化和投融资层面。
总体来看,免疫细胞疗法在细胞与基因治疗领域中已达到较高的成熟度,并已获得广泛的科学与经济认可。随着技术的不断进步和临床应用的拓展,免疫细胞治疗未来有望在更多疾病领域取得突破,为患者带来更多希望与治疗选择。
参考文献
[1] https://mp.weixin.qq.com/s/vZVPtIUbT9b1lqHWEJJQUw
[2] 范月蕾,李荣,李斌,等.免疫细胞治疗科技创新与产业发展态势[J/OL].生命科学,1-19[2025-01-15].
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|Yuanyuan.ZG
审核|Geng.ZG

