
骨性关节炎(Osteoarthritis, OA)是一种严重影响患者生活质量的慢性、退行性关节疾病。近年来,外泌体作为细胞间通讯的重要媒介,在骨性关节炎的诊疗中逐渐崭露头角。特别是不同干细胞来源的外泌体及其携带的非编码RNA(如lncRNA、miRNA等),为骨性关节炎的诊断和治疗提供了新的视角和潜在的治疗手段。
骨性关节炎
骨性关节炎,这一常见于老年人群的退行性病变,不仅对个人生活质量造成严重影响,还带来了巨大的社会经济负担。其核心病理在于关节软骨的局部损伤,并伴随着滑膜、韧带、软骨下骨、关节软骨及周围肌肉等整个关节结构的全面退化。
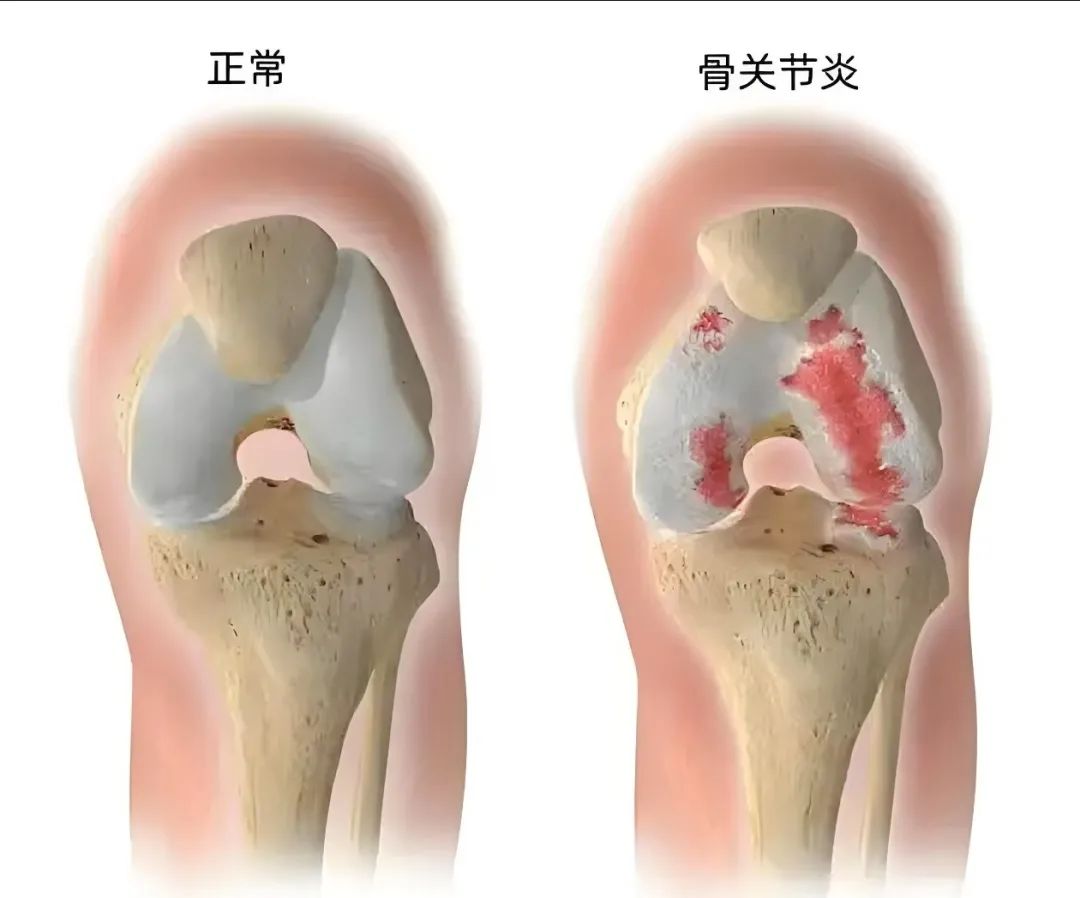
尽管其发病机制尚未完全清晰,但已确认多种因素参与其中,如Wnt/β-catenin、NF-κB等细胞信号通路的异常,凋亡、缺氧诱导因子等生物学过程的失衡,以及骨形成蛋白、成纤维细胞转导因子等分子的功能紊乱。此外,巨噬细胞自噬清除功能的异常、转录因子和miRNA调控的失衡,以及肿瘤坏死因子α、白细胞介素1、白细胞介素6与白细胞介素10等炎症因子的不平衡,也是骨性关节炎发病机制中的重要因素。
当前,骨性关节炎的治疗主要依据Kellgren Lawrence (KL)分级,采取阶梯式治疗方案,包括药物治疗、膝关节部分置换术及人工膝关节置换术等。然而,药物治疗的效果往往只能暂时缓解症状,而关节置换术虽对中晚期患者有一定疗效,但高昂的费用、假体寿命的限制以及手术风险等问题,使其应用受到一定限制。因此,寻找更为安全有效的治疗手段显得尤为迫切。
外泌体
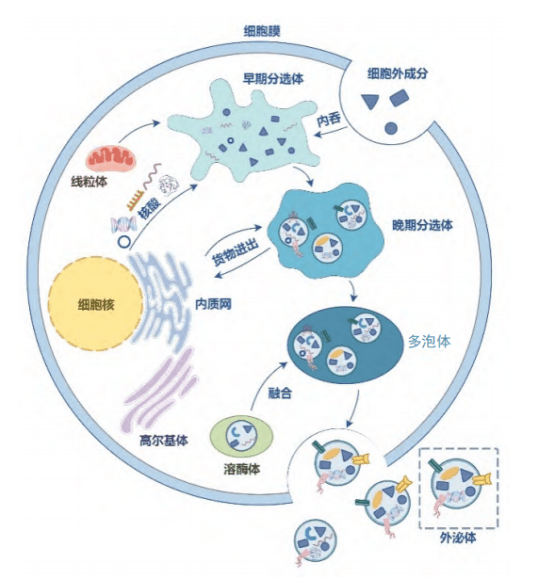
外泌体是由细胞分泌的一种直径约为30-150纳米的纳米级细胞外囊泡,内含丰富的细胞成分,如图1所示,包括DNA、RNA(涵盖编码RNA和非编码RNA)、脂质、代谢物以及胞质和细胞表面蛋白等。这些成分使外泌体在细胞间通讯、免疫反应、病毒致病性、妊娠、心血管疾病、中枢神经系统相关疾病和癌症等多种生理病理过程中发挥着关键作用,成为细胞间沟通的重要桥梁。
在骨性关节炎中,滑液中的外泌体不仅参与软骨细胞及相关炎症细胞的生物过程,还通过细胞间通讯对受体细胞进行调控,影响软骨细胞的增殖、代谢、凋亡以及关节炎症的进程,从而成为疾病进展的关键因素及诊断和治疗的新靶点。外泌体被受体细胞内吞后,能精确传递所携带的分子给目标细胞,诱导特定的表型变化。它们还能召集免疫细胞维持滑膜炎症,促进炎性因子释放,并激活M1巨噬细胞加剧炎症和软骨变性。尤为引人注目的是,外泌体通过传递特定的miRNA和lncRNA精细调节骨性关节炎相关细胞的生物学功能,促进软骨异常钙化与破坏,诱导关节软骨细胞改变。此外,外泌体还通过上调特定基因表达,阻断软骨细胞与神经元信号交流,为缓解骨性关节炎疼痛提供新途径,展现了在骨性关节炎治疗中的巨大潜力。
外泌体在骨性关节炎诊断中的应用
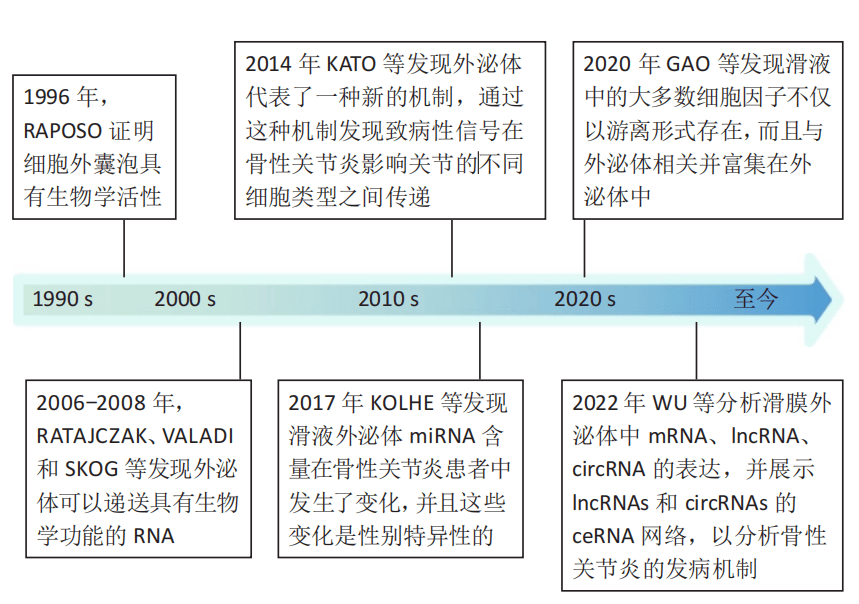
外泌体在骨性关节炎患者滑液和血浆中可以被检测到,其水平随着疾病的进展而不断变化。这一特性使得外泌体有望成为骨性关节炎早期诊断的生物标志物。
RNA作为生物标志物
研究发现,骨性关节炎患者滑膜和血浆外泌体中的RNA表达谱与健康人存在显著差异。这些差异表达的RNA包括mRNA、lncRNA、circRNA和miRNA等,它们可能在骨性关节炎的病理机制中发挥重要作用。例如,某些特定的miRNA在骨性关节炎患者滑液外泌体中的表达水平显著上调或下调,这些变化可能与疾病的进展和性别差异有关。此外,lncRNA和circRNA也展现出作为骨性关节炎生物标志物的潜力。
蛋白质和脂类作为生物标志物
除了RNA外,外泌体中的蛋白质和脂类也可作为骨性关节炎的生物标志物。研究发现,骨性关节炎患者滑液外泌体中的某些细胞因子(如白细胞介素1β、白细胞介素17等)水平明显高于健康人。这些细胞因子不仅以游离形式存在,还富集于外泌体中,进一步证明了外泌体作为疾病诊断工具的可行性。
不同来源外泌体在骨性关节炎治疗中的作用
近年来,干细胞疗法已成为骨性关节炎临床前和临床姑息治疗的一种选择。其中,干细胞来源的外泌体作为一种无细胞疗法,展现出了巨大的治疗潜力。不同来源的干细胞外泌体在骨性关节炎治疗中发挥着不同的作用机制。
骨髓间充质干细胞来源外泌体(BMSC-Exos)
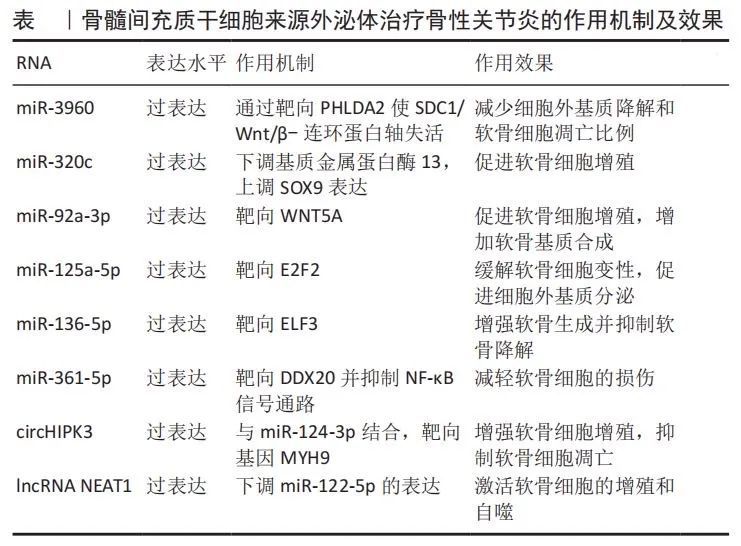
BMSC-Exos,即骨髓间充质干细胞来源的外泌体,作为来源于骨髓基质干细胞(具有分化为成骨、脂肪、软骨等多种潜能的细胞亚群)的微小囊泡,在骨性关节炎治疗中展现出显著疗效。它们不仅能够促进成骨和血管生成,还能极大地促进受损软骨和软骨下骨的修复。通过外泌体中携带的lncRNA、miRNA等非编码RNA,BMSC-Exos能够逆转白细胞介素1β诱导的软骨细胞凋亡,并促进软骨细胞的增殖和迁移。具体来说,BMSC-Exos中的lncRNA如LYRM4-AS1通过调节GRPR-miR-6515-5p通路减轻白细胞介素1β对软骨细胞的损伤,而过表达特定miRNA(如miR-326、miR-3960等)的BMSC-Exos能进一步增强其治疗效果。此外,BMSC-Exos还能上调Ⅱ型胶原α1和聚集蛋白聚糖的表达,并下调基质金属蛋白酶13和ADAMTS5的表达,从而显著消除白细胞介素1β对软骨细胞增殖和迁移的抑制作用,有效促进骨性关节炎软骨的修复和合成。
脂肪间充质干细胞来源外泌体(ADSC-Exos)
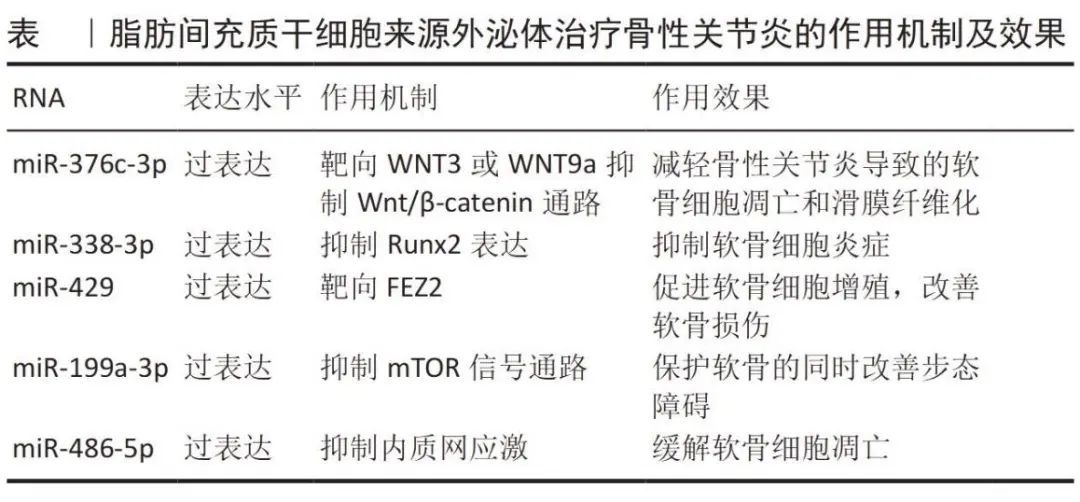
脂肪间充质干细胞衍生的外泌体(ADSC-Exos)在治疗骨性关节炎领域具有显著的前景。它们源自人体充裕的脂肪组织中的脂肪间充质干细胞,易于获取,构成了理想的细胞治疗基础。这些干细胞具备分化为软骨细胞的能力,并能释放促进软骨修复的生长因子,通过自体细胞关节内注射,已临床验证能有效提升骨性关节炎患者的关节机能并减轻痛感。ADSC-Exos借助旁分泌机制,积极调节软骨形成相关的miRNA(例如miR-145和miR-221),同时遏制炎症信号及促炎因子的表达,降低白细胞介素6、NF-κB和肿瘤坏死因子α的水平,提升抗炎细胞因子白细胞介素10的含量,有效抵御H2O2诱导的软骨细胞凋亡。更深入的探索揭示,通过特定miRNA(诸如miR-376c-3p、miR-338-3p、miR-429、miR-199a-3p和miR-486-5p)的过表达,ADSC-Exos能进一步增强其疗效,精准抑制Wnt/β-catenin通路,缓解软骨细胞凋亡和滑膜纤维化,同时抑制内质网应激,加速基质再生。ADSC-Exos对软骨细胞的迁移和增殖具有显著促进作用,有效应对软骨损伤,且在人体试验中展现出良好的治疗成效。考虑到脂肪间充质干细胞可依据患者特异性获取且理论上资源无限,ADSC-Exos预示着未来在骨性关节炎治疗领域的广阔应用前景。
其他干细胞来源外泌体
除了BMSC-Exos和ADSC-Exos外,其他干细胞来源的外泌体也在骨性关节炎治疗中展现出一定的潜力。例如,牙髓干细胞来源外泌体(DPSC-Exos)能够促进软骨细胞相关mRNA的表达,包括聚集蛋白聚糖、Ⅱ型胶原α1和SOX9等,从而改善骨性关节炎的症状。此外,羊水干细胞来源外泌体(AFSC-Exos)、胚胎间充质干细胞来源外泌体(EMSC-Exos)以及诱导多能干细胞来源间充质干细胞外泌体(iPS-MSCs-Exos)等也在骨性关节炎治疗中展现出不同的治疗效果。
前景展望
尽管天然外泌体在骨性关节炎治疗中展现出巨大的潜力,但其数量有限且成分复杂多变,限制了其在临床应用中的广泛使用。因此,工程化外泌体的开发成为了一个重要的研究方向。
工程化外泌体通过利用细胞分泌的天然外泌体装载蛋白或核酸等药物,通过工程化技术优化外泌体的载荷,使其能够高效携带和递送更多种类的治疗分子。这种方法不仅增强了治疗的特异性和效率,还提升了外泌体的荷载能力,使其能更高效地携带并递送治疗分子。通过编辑外泌体中的RNA(特别是miRNA),可以使其针对特定的疾病靶点发挥作用,从而增强治疗效果。此外,工程化外泌体还可以实现标准化和规模化生产,为其在临床上的应用提供了更大的可能性。
参考文献
[1]王喆,齐岩松,徐永胜 . 不同干细胞来源外泌体及其携非编码 RNA 诊疗骨性关节炎 [J]. 中国组织工程研究,2025, 29(19):4122-4131.
[2]YAO Q, WU X, TAO C, et al. Osteoarthritis: pathogenic signaling pathways and therapeutic targets. Signal Transduct Target Ther. 2023;8(1):56.
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|Ning.ZG
审核|Geng.ZG

