
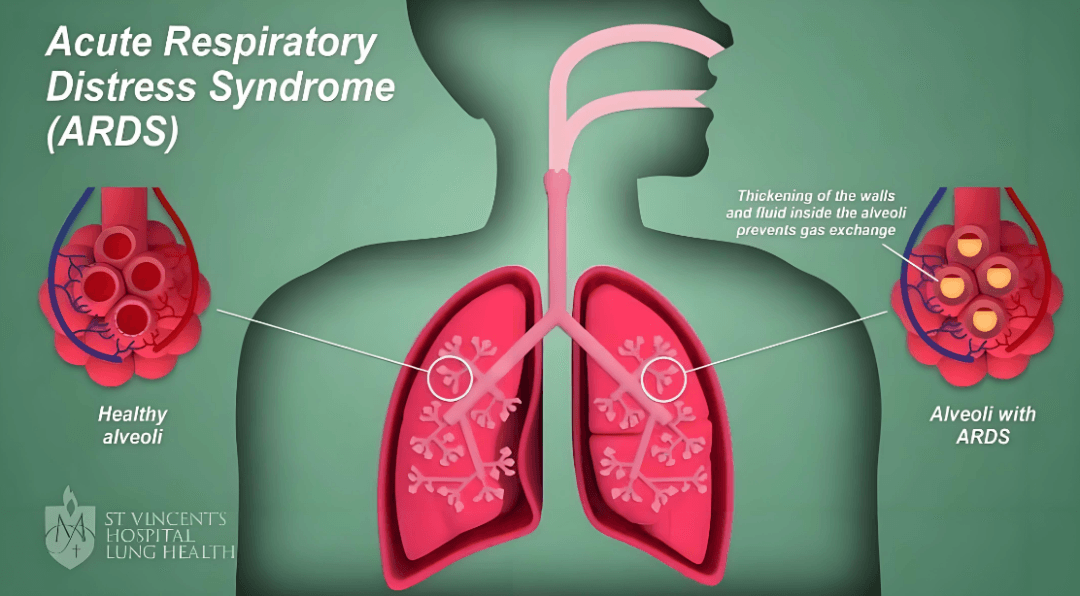
认 识 ARDS
在重症监护室(ICU)急促的报警声中,急性呼吸窘迫综合征(ARDS)如同一场在肺部爆发的毁灭性“炎症风暴”,无情地剥夺着患者的呼吸能力。它是脓毒症、重症肺炎(如COVID-19)、严重创伤、误吸等多种打击后常见的致命并发症。即便在全球顶级医疗中心的全力救治下,其死亡率仍高达惊人的30%-40%。传统治疗虽能维持生命,却常难逆转根本损伤。而今,源自生命奥秘的干细胞疗法,正以其强大的免疫调控和组织修复能力,成为对抗这场“肺部风暴”最富前景的战略性武器。

ARDS并非单一疾病,而是由多种直接(肺炎、误吸)或间接(脓毒症、胰腺炎、严重创伤)肺损伤因素引发的急性、弥漫性肺部炎症反应综合征。其核心特征为:
1. 失控的炎症风暴: 病原体或损伤信号触发免疫系统过度激活,大量炎症细胞(中性粒细胞、巨噬细胞等)涌入肺部,释放“细胞因子风暴”,导致肺泡和毛细血管广泛损伤。
2. 肺泡-毛细血管屏障破坏: 炎症导致肺泡上皮细胞和血管内皮细胞严重受损,通透性大大增加,富含蛋白质的液体渗入肺泡间隙和肺泡腔内,形成肺水肿。
3. 肺泡萎陷与肺顺应性下降: 表面活性物质失活及渗出液导致肺泡萎陷,肺组织变得僵硬、难以膨胀。
4. 顽固性低氧血症:以上病变严重阻碍氧气交换,导致患者即使吸入高浓度氧气也难以纠正的低血氧水平。
现 有 治 疗 的 困 境
当前ARDS治疗的核心支柱:
肺保护性机械通气:使用小潮气量、适度呼气末正压的策略维持氧气交换,减少呼吸机相关肺损伤(VALI)。是生存率提高的关键,但无法修复肺损伤。
俯卧位通气:改善通气血流比,显著提升氧合。需要专业团队操作,对部分患者效果有限。
液体精细化管理:通过限制性补液和使用利尿剂减轻肺水肿。过度限制又可能影响器官灌注。
对症支持治疗:如抗感染、营养支持、血液动力学维持等。
体外膜肺氧合:对于难治性严重ARDS,ECMO提供了最后的救命手段,但费用昂贵、操作复杂、并发症风险高。
治疗瓶颈凸显: 这些措施为肺脏的自愈争取了宝贵时间,但它们无法:
快速有效地控制失控的炎症反应。
主动修复受损的肺泡上皮和血管内皮屏障。
预防和逆转肺纤维化进展。
而干细胞疗法,恰恰以其独特的生物学特性,瞄准了这些核心痛点!
干 细 胞 修 复 创 伤 的 生 命 之 钥
在ARDS的战场上,干细胞(尤其是间充质干细胞,因其免疫原性低、安全性好,成为主力军)扮演着“多面救火队员”和“超级修复工”的角色。其核心机制在于:
1强大的免疫调节与抗炎
熄灭“细胞因子风暴”:MSC通过分泌多种生物活性因子(如IL-10, TGF-β, PGE2, TSG-6等),直接抑制过度激活的免疫细胞(如巨噬细胞从促炎M1型转向抗炎M2型),中和有害的炎症因子(TNF-α, IL-1β, IL-6等)。
调节T细胞平衡: 促进调节性T细胞的生成和功能,抑制效应T细胞的过度反应。
创造抗炎微环境: 改变肺组织局部微环境,使其有利于炎症消退和组织修复。
2促进组织修复与再生的核心功能
增强肺屏障完整性:分泌血管生成素-1等因子,稳定和修复受损的血管内皮细胞,减少渗漏。分泌KGF等因子,直接或间接促进肺泡上皮细胞(尤其是II型上皮细胞)的增殖、迁移和存活,修复肺泡上皮屏障。II型上皮细胞的修复对于产生肺表面活性物质至关重要。
减轻肺纤维化风险: 抑制成纤维细胞的异常增殖和活化,减少胶原沉积,有助于维持肺结构的弹性。
清除病原体与损伤细胞碎片(增强吞噬作用):部分通过旁分泌效应调节巨噬细胞的吞噬功能。
保护远端器官:减轻肺部炎症也可减轻对其他脏器(如肾脏、心脏)的损害。
3抗微生物和促血管生成作用
在某些情况下有助于改善微循环和控制感染。
值得注意的是: MSC发挥作用的主要方式并非直接大规模分化成肺细胞(如肺泡上皮细胞),而是通过其强大的“旁分泌”作用(即分泌大量具有生物活性的小分子和囊泡)来调节免疫、促进内源性修复细胞的再生。这一特性让MSC能在输入后快速(几小时内)起效,至关重要!
从 实 验 室 到 病 床
全球首例COVID-19严重ARDS患者的同情用药(2020) 及后续早期研究显示MSC输注的可行性和潜在有效性。
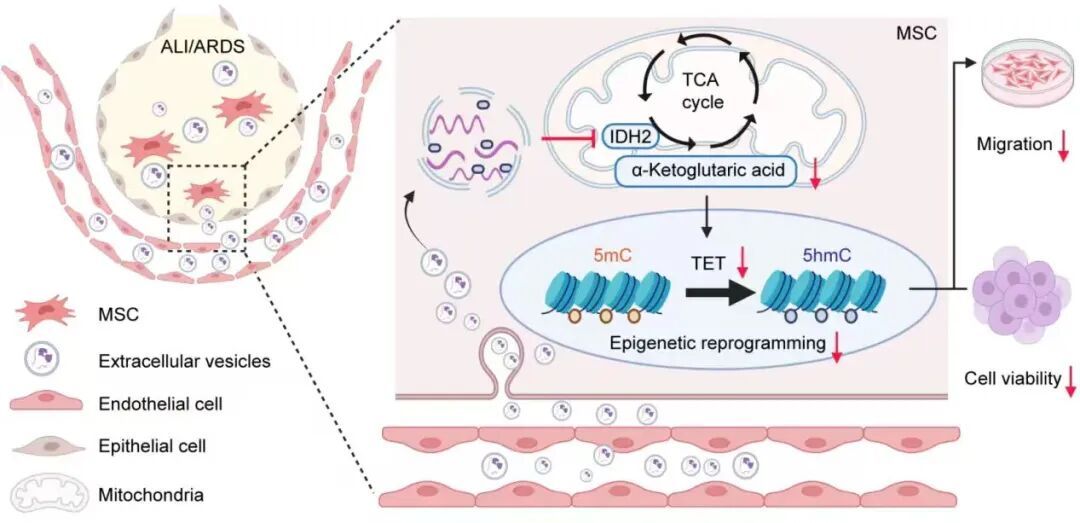
在最近的一项研究中,来自东南大学的研究团队在《Cell Commun Signal》(IF=8.2) 发表的研究型论文引起了热议,揭示了细胞外囊泡对MSC治疗效果的影响。研究团队首先建立了脂多糖诱导的急性肺损伤(Acute lung injury,ALI)模型,以评估内皮细胞来源的EVs(EC-EVs)对骨髓来源的MSC(BM-MSC)移植修复肺损伤效果的影响。

这项研究发现,ARDS肺微环境中EC-EVs显著增加,这些EC-EVs通过抑制MSCs的细胞活力和迁移能力,减弱其对ARDS肺损伤的修复作用。进一步机制研究表明,病理状态下产生的EC-EVs通过下调三羧酸循环(TCA)中异柠檬酸脱氢酶2(IDH2)的表达,减少α-酮戊二酸(α-KG)生成,进而抑制MSCs中羟甲基化关键酶TET活性,降低MSCs的修复功能。
结 语
干细胞疗法为笼罩在ARDS阴霾下的生命点燃了一束前所未有的希望之光。它跳出了传统“支持性治疗”的框架,直面疾病的本质矛盾——从根源上调控失控的免疫反应,并积极修复受损的肺组织屏障这不仅有望大幅降低ARDS的死亡率,更能改善幸存者的长期肺功能和整体预后,减少医疗资源消耗。
每一例临床试验的成功案例、每一项机制研究的突破,都在坚定地推动着这艘“生命方舟”驶向临床实践的彼岸。
参考文献
Wu X, Tang Y, Lu X, Liu Y, Liu X, Sun Q, Wang L, Huang W, Liu A, Liu L, Chao J, Zhang X, Qiu H. Endothelial cell-derived extracellular vesicles modulate the therapeutic efficacy of mesenchymal stem cells through IDH2/TET pathway in ARDS. Cell Commun Signal. 2024 May 27;22(1):293. doi: 10.1186/s12964-024-01672-0. PMID: 38802896; PMCID: PMC11129421.
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|Zhang.ZG
审核|Geng.ZG

