
胰腺癌作为一种恶性程度高、预后极差的肿瘤,素有“癌中之王”之称。其起源于胰腺,具有高度的侵袭性和转移性,对人类的生命健康构成了严重威胁。从流行病学特征来看,全球及我国胰腺癌的发病率和死亡率均呈上升趋势,且我国的增速显著高于全球。这一趋势可能与人口老龄化、诊断技术提升及医疗资源分布不均等多种因素有关。此外,胰腺癌的发病率和死亡率均随年龄增长而上升,且男性显著高于女性,这可能与男性更高的吸烟率及职业暴露风险有关。
1 胰腺癌七大致命特征
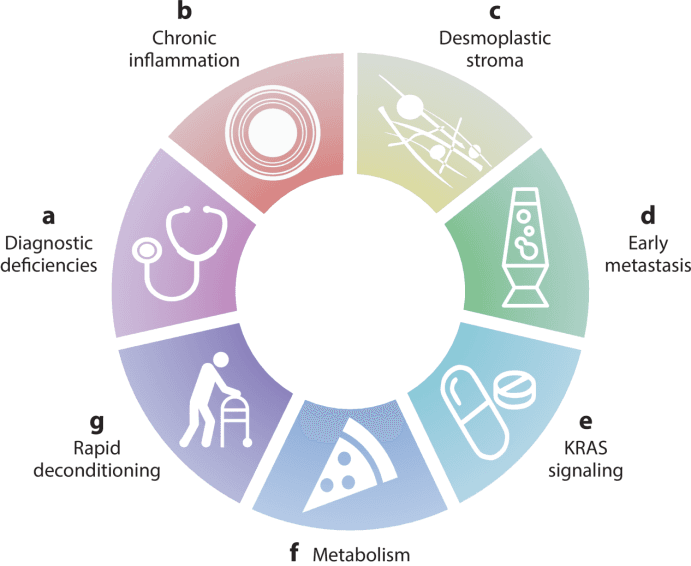
诊断不足(Diagnostic Deficiencies):缺乏有效的早期诊断方法,大多数患者在确诊时已是晚期,限制了治疗选择,降低了生存率。
慢性炎症(Chronic Inflammation):胰腺癌的发生与慢性炎症密切相关,如胰腺炎、吸烟、饮酒、糖尿病和肥胖等风险因素均会促进炎症发生,进而推动肿瘤进展。炎症不仅促进肿瘤生长,还抑制免疫系统对肿瘤的攻击。
致密基质(Desmoplastic Stroma):胰腺癌周围有大量纤维组织(基质),这些基质限制了药物和免疫细胞的渗透,保护了肿瘤细胞,使得化疗和免疫治疗难以达到理想效果。
早期转移(Early Metastasis):胰腺癌细胞在早期就具有转移能力,即使手术切除原发灶,也常因微小转移灶的存在而复发,导致治疗难度增加,预后极差。
KRAS信号通路(KRAS Signaling):超过90%的胰腺癌患者存在KRAS基因突变,这一突变驱动了肿瘤细胞的持续增殖和生存,使得肿瘤细胞对传统治疗不敏感,且容易产生耐药性。
代谢异常(Metabolism):胰腺癌细胞具有独特的代谢特征,如高水平的糖酵解和谷氨酰胺代谢,这些代谢途径为肿瘤细胞提供了生长和生存所需的能量和物质,使得肿瘤细胞能够在恶劣的肿瘤微环境中生存,并对治疗产生抵抗。
快速衰弱(Rapid Deconditioning):胰腺癌患者常因胰腺外分泌功能不全和营养不良而出现体重减轻、肌肉和脂肪消耗等衰弱症状。限制了患者对治疗的耐受性,降低了生活质量,并可能加速病情进展。
2 胰腺癌的治疗
在诊治进展方面,胰腺癌的治疗目前已经从单一的手术治疗转变为综合治疗模式,包括手术、化疗、放疗、免疫治疗和靶向治疗等多种手段。多学科共同决策的综合治疗模式逐渐成为主流,实现了治疗的个体化、精细化和精准化。同时,手术技术也在不断创新,如机器人手术的应用,显著提高了手术质量和患者预后。此外,新辅助治疗、靶向与免疫治疗等新型治疗手段也取得了显著进展,为部分患者提供了新的治疗选择。在早期诊断方面,随着人工智能的发展,AI在胰腺癌早期诊断中的应用前景广阔,为胰腺癌的早期发现提供了新的手段。
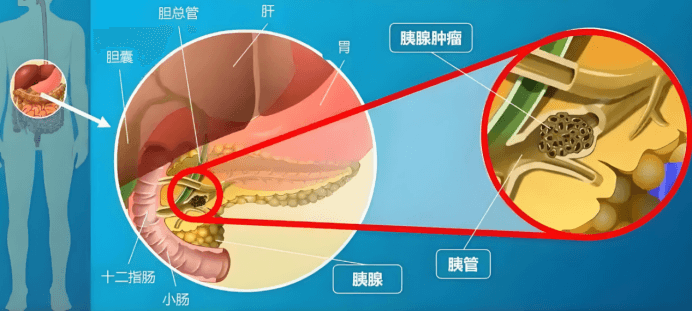
胰腺癌难治疗的关键原因
1、诊断困难:胰腺癌早期症状不明显,很难在早期被发现,大多数患者在确诊时病情已经进展到晚期,错过了最佳治疗时机。
2、高度侵袭性和转移性:胰腺癌细胞具有极强的侵袭性,容易早期发生转移,尤其是肝脏和肺部,这使得手术难以完全切除肿瘤,复发率高。
3、肿瘤微环境复杂:胰腺癌周围环绕着大量的纤维组织(称为基质),这些基质不仅阻碍了药物和免疫细胞的渗透,还为肿瘤细胞提供了保护,使得治疗难以奏效。
4、基因突变复杂:胰腺癌中常见的基因突变(如KRAS突变)使得肿瘤细胞对传统化疗和放疗不敏感,且容易产生耐药性。
NKT细胞治疗胰腺癌
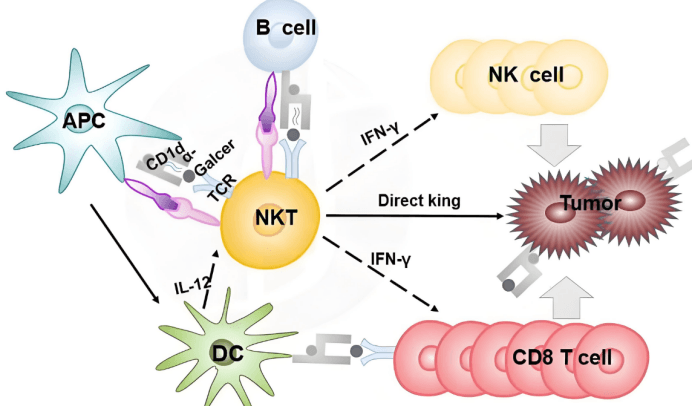
NKT细胞(自然杀伤T细胞)是一种进化上保守的先天性T细胞亚群,在胰腺癌的治疗中展现出巨大的潜力。NKT细胞表达NK细胞表面标记和不变的Vα24-Jα18 TCR α链,通过CD1d分子识别自我和微生物糖脂抗原。它们具有强大的固有抗肿瘤活性,能够通过其内源性TCR识别由CD1d呈递的糖脂抗原而被激活,例如使用α-GalCer(α-半乳糖神经酰胺)这种CD1d配体,就能诱导NKT细胞产生IL-4和干扰素γ(IFN-γ),从而发挥抗肿瘤作用。尽管大多数实体瘤CD1d阴性,但NKT细胞在多种癌症模型中已显示出抗肿瘤潜力。
NKT细胞治疗胰腺癌的治疗原理
主要在于激活NKT细胞的抗肿瘤活性,并通过双特异性抗体增强其靶向性。使用α-GalCer等CD1d配体激活NKT细胞,可以诱导其产生细胞因子并增强抗肿瘤活性。同时,MSLN/CD3双特异性抗体(BsAb)被用于重定向NKT细胞至过度表达MSLN(间皮素)的肿瘤细胞,实现T细胞介导的细胞毒性和肿瘤细胞消除。NKT细胞与双特异性抗体结合,通过双重机制(抗体依赖性和细胞介导的细胞毒性)增强抗肿瘤效果。此外,NKT细胞的激活还能促进其他免疫细胞的招募和激活,形成更广泛的抗肿瘤免疫反应。
3 案例分享
NKT细胞:抗肿瘤的“侦察兵”
研究发现,自然杀伤性T细胞(NKT细胞)的免疫细胞在胰腺癌中很关键。NKT细胞就像免疫系统的“侦察兵”,能通过以下方式对抗肿瘤:
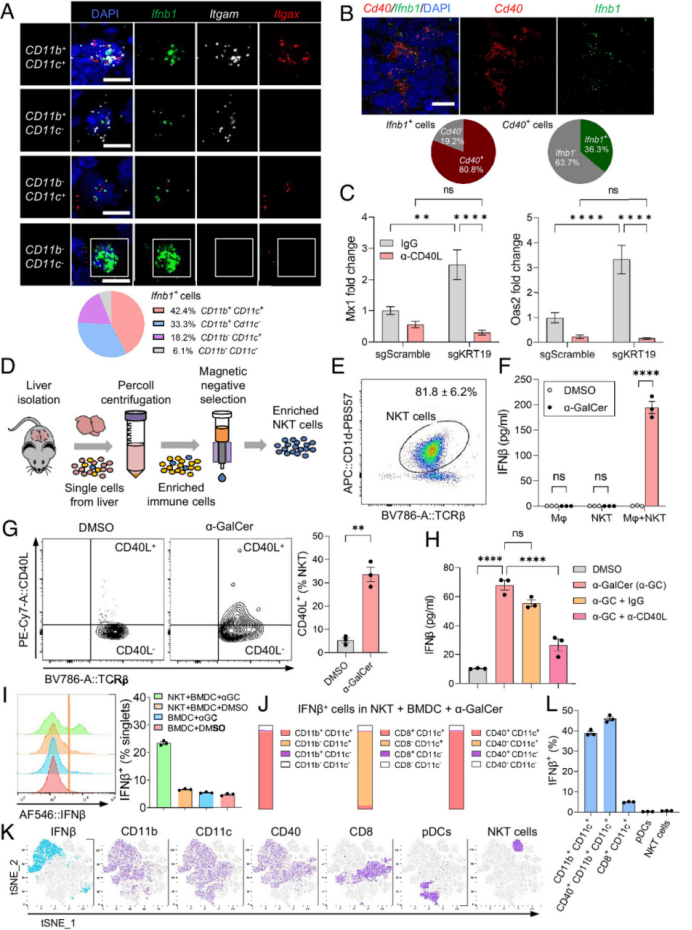
激活先天免疫:NKT细胞表面有一个叫CD40L的分子,它能与肿瘤微环境中的“哨兵”细胞(如巨噬细胞、树突状细胞)表面的CD40分子结合,刺激这些细胞产生I型干扰素(IFN-β)。I型干扰素就像“战斗号角”,能唤醒其他免疫细胞(如T细胞、NK细胞),让它们进入肿瘤内部攻击癌细胞。
重塑免疫微环境:在缺乏NKT细胞的小鼠模型中,肿瘤里的T细胞、树突状细胞明显减少,抑制免疫的MDSCs增多,肿瘤生长更快。这说明NKT细胞是形成“免疫活跃型”微环境的关键。
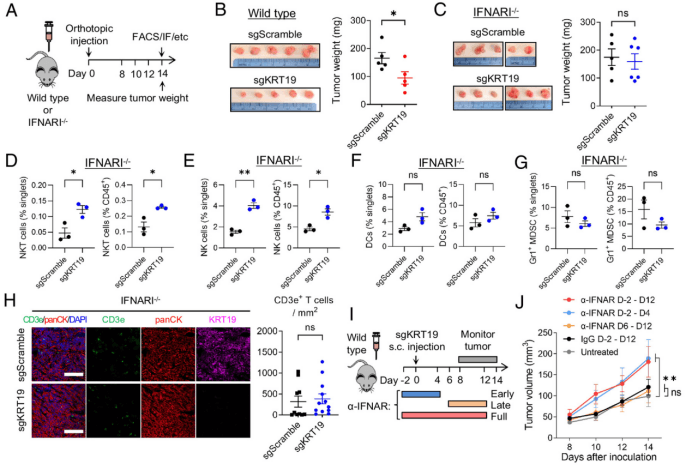
NKT细胞、I型IFN产生和CD40-CD40L信号传导。研究人员通过将sgKRT19编辑和sgScramble对照PDA细胞接种到IFN-α受体I敲除中(IFNARI−/−)小鼠(图A)。与野生型小鼠中sgScramble对照PDA肿瘤相比,sgKRT19编辑的PDA肿瘤较小(图B),两种肿瘤的大小在IFNARI中相似−/−原位和s.c.模型中的小鼠(图C)。因此,I型IFN信号转导是sgKRT19编辑肿瘤免疫控制所必需的。在IFNARI中生长的sgKRT19编辑的PDA肿瘤中,NKT细胞和NK细胞的积累增强得以维持−/−小鼠(图D和E),表明它们在瘤内的存在不依赖于I型IFN信号传导。相比之下,在IFNARI中生成sgKRT19编辑和sgScramble对照原位PDA肿瘤之间浸润T细胞、DC和MDSC的差异减弱−/−小鼠(图F-H)。因此,NKT细胞的功能位于I型IFN的上游,并且可能是sgKRT19编辑肿瘤中的适应性免疫反应。
为了鉴定在sgKRT19编辑的PDA肿瘤中产生I型IFN的细胞类型,研究人员关注到瘤内CD11c和CD11b细胞,据报道这些细胞在其他癌症中是产生I型IFN的细胞。通过RNA荧光原位杂交(RNA-FISH)和对Itgax(编码CD11c)、Itgam(编码CD11b)和Ifnb1具有特异性的探针,发现在sgKRT19编辑的PDA肿瘤中,Ifnb1mRNA主要存在于表达CD11b和/或CD11c(~94%)的细胞中(图A)。此外,在产生IFNβ的细胞中,CD11bCD11c细胞最丰富(~42%)。因此,得出结论,骨髓细胞是sgKRT19编辑的PDA肿瘤中I型IFN的主要来源。
亚叶酸(FA):让NKT细胞“变多变强”
研究人员发现,亚叶酸(FA,叶酸的衍生物)能通过口服给药,增加肿瘤内NKT细胞的数量。FA处理后,肿瘤中的I型干扰素信号增强,免疫检查点治疗(如抗PD-1抗体)的效果也大幅提升。在小鼠实验中,FA与抗PD-1联用能显著抑制肿瘤生长,而单独使用两者效果都不好。这提示FA可能成为增强胰腺癌免疫治疗的“助力剂”。
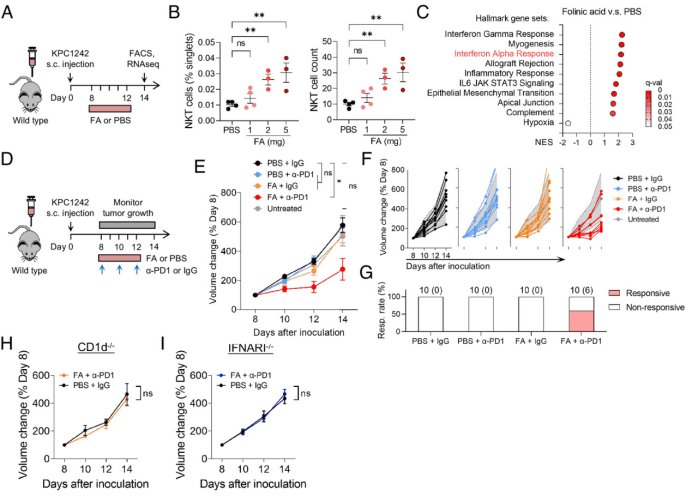
FA也称为亚叶酸,可诱导NKT细胞在新生小鼠肠道中积累。当用口服FA治疗携带未修饰的亲本KPC1242s.c.PDA肿瘤的小鼠时,观察到肿瘤中NKT细胞的剂量依赖性增加(图A和B)。与对照组小鼠相比,确定了FA处理组上调的多种免疫反应通路(图C)。值得注意的是,在FA处理的KPC1242s.c.PDA肿瘤中,I型IFN信号转导上调,同时NKT细胞积累增加。
4 小结
NKT细胞治疗胰腺癌的优势在于其强大的抗肿瘤活性、较低的毒性以及与其他免疫疗法的协同作用。然而,NKT细胞治疗也面临一些局限性,如NKT细胞的体外激活和扩增可能面临技术挑战,不同患者之间NKT细胞的数量和功能可能存在差异,胰腺癌的肿瘤微环境可能具有高度的免疫抑制性从而限制NKT细胞的浸润和活性,以及长期疗效和耐药性问题仍需进一步研究。
参考文献
[1]胰腺癌诊治的进展与思考
[2]1990–2021 年全球和中国胰腺癌的疾病负担分析及其未来趋势预测
[3]Intratumoral NKT cell accumulation promotes antitumor immunity in pancreatic cancer
[4]Road Map to Defeat Pancreatic Cancer
[5]Efficacy of natural killer T and gammadelta T cells in mesothelin-targeted immunotherapy of pancreatic cancer
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|Yuanyuan.ZG
审核|Geng.ZG

