
在攻克艾滋病的征程中,重大突破再次降临。第 25 届世界艾滋病大会于德国慕尼黑盛大召开,德国沙里泰大学医院等机构的研究团队发布重磅消息:一位 60 岁的德国男性艾滋病患者被确认为全球第七例艾滋病治愈者。
艾滋病全球现状:严峻的挑战
艾滋病作为全球性健康难题,形势极为严峻。联合国艾滋病规划署报告显示,截至 2023 年底,全球约 3990 万人感染 HIV。2023 年,新增 HIV 感染者达 130 万,63 万人因艾滋病相关疾病离世。尽管全球艾滋病防治工作取得一定进展,如 2023 年新增感染者数量创 20 世纪 80 年代末以来新低,艾滋病相关死亡人数降至 2004 年高峰后的最低水平,但距离联合国 2030 年终结艾滋病流行的目标仍有较大差距。全球近 4000 万感染者中,约 930 万人未接受抗逆转录病毒治疗,至少 28 个国家新增感染者数量呈上升趋势,防治工作任重道远。
艾滋病由 HIV 病毒引发,主要攻击人体免疫系统中的 CD4 + T 淋巴细胞。病毒入侵后,大量破坏该细胞,致使细胞数量锐减、功能受损,细胞免疫功能缺陷,免疫系统防御能力衰退,人体易遭受带状疱疹、结核病、肺炎、脑炎等多种病原体侵袭,甚至引发全身器官衰竭。
艾滋病传播途径
艾滋病传播途径主要有三种。性接触传播居首,不安全的同性、异性和双性性接触均可传播,艾滋病感染者的阴道分泌物和精液含大量病毒,性接触时生殖器黏膜摩擦损伤,病毒趁机入血。
在我国,性传播是艾滋病传播的主要途径。血液传播次之,共用注射器、针头、药棉,被艾滋病病毒污染的锐器或针头刺破皮肤,使用污染血制品,不规范医疗操作(如牙科操作),以及移植感染艾滋病病毒的器官、医务人员职业暴露等均可导致病毒通过血液传播。母婴传播同样不容忽视,艾滋病妇女妊娠、分娩过程中可将病毒传给胎儿,分娩时或哺乳阶段也可传染新生儿,影响其发育成长。不过,日常社交接触如握手、拥抱、共用餐具、同处办公或教室等,不会传播艾滋病,公众应正确认识艾滋病,科学预防。
干细胞治疗艾滋病:原理与困境
干细胞治疗艾滋病的关键在于 CCR5 基因编码的 CCR5 蛋白。在艾滋病病毒入侵人体免疫细胞时,CCR5 蛋白扮演着辅助受体的重要角色,犹如免疫细胞城堡的特殊入口,助力 HIV 病毒顺利侵入 CD4 + T 淋巴细胞。病毒在细胞内大量复制增殖,持续破坏淋巴细胞,致人体免疫系统崩溃,丧失免疫功能,易患各种疾病甚至恶性肿瘤。自然界中存在 CCR5 基因特定突变形成的 CCR5Δ32,此突变可关闭病毒入侵的“入口”,使人体对 HIV 产生免疫。这一基因突变为干细胞治疗艾滋病提供了重要理论依据与作用靶点。
干细胞移植治疗艾滋病的核心策略是寻找 CCR5Δ32 突变供体,获取其干细胞并移植到 HIV 感染者体内,为患者重建带有“防御升级”的免疫系统。这些特殊干细胞在患者体内分化、替代受损免疫细胞,新免疫系统因 CCR5Δ32 突变而对 HIV 病毒产生抵抗力,有望实现艾滋病的治疗与治愈。然而,干细胞移植治疗艾滋病在实际应用中面临诸多挑战与局限。

其一,寻找 CCR5Δ32 突变供体极为困难。欧洲血统人群中,仅约 1% 携带 CCR5 基因双副本突变,约 10% 携带一个副本突变,其他地区比例更低,非洲人群几乎无此突变,亚洲仅有少量人口拥有,我国也鲜有发现,极大限制了治疗患者数量。
其二,干细胞移植本身操作复杂、风险极高。移植前患者需接受预处理,清除体内原有白细胞,此时人体免疫力极低,易受病原体感染,严重时可危及生命。即便移植成功,人体还可能出现排异反应与并发症,约 10% 接受异体移植的患者可能因此丧生。其三,对于利用除 CCR5 外其他受体(如 CXCR4 蛋白受体)或多种受体“入侵通道”的 HIV 毒株,该治疗方法可能效果不佳。因此,干细胞移植虽为艾滋病治疗带来希望,但要成为常规治疗手段,仍需科研人员攻克诸多难题。
首例接受 CCR5-delta32 杂合突变的 HIV 治愈病例
回溯其患病历程,2009 年确诊感染艾滋病病毒后,命运的重击接踵而至,2015 年又被诊断患有急性骨髓性白血病。然而,白血病的治疗契机——干细胞移植,成为他命运的转折点。自 2018 年 9 月停止抗逆转录病毒治疗起,历经多项检测,艾滋病病毒踪迹全无,长达近 6 年的时间,他成功打破常规。
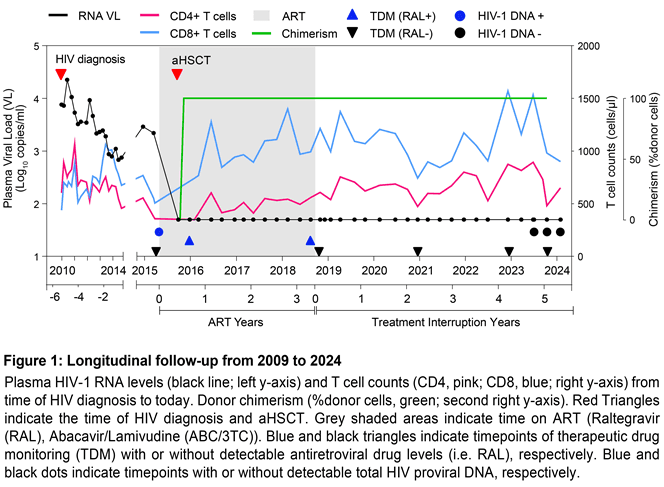
此前,全球已有六例艾滋病治愈者,分别被称为“柏林病人”“伦敦病人”“杜塞尔多夫病人”“纽约病人”“希望之城病人”和“日内瓦病人”,他们均借助干细胞移植重获新生。
而这位第七例治愈者情况特殊,其干细胞捐赠者的 CCR5 基因仅有一个副本发生突变。CCR5 蛋白是艾滋病病毒入侵免疫细胞的关键受体,CCR5 基因也因此成为治愈艾滋病的核心靶点。
此前治愈患者中,除“日内瓦病人”的干细胞捐赠者 CCR5 基因双副本无突变外,其余 5 位患者的捐赠者 CCR5 基因双副本均有突变,无法表达协助艾滋病病毒入侵的 CCR5 蛋白。在欧洲血统人群中,仅约 1% 个体携带 CCR5 基因双副本突变,约 10% 携带一个副本突变。这位德国患者自身也携带一个 CCR5 基因副本突变,双重因素叠加,为艾滋病病毒入侵构建起额外防线。
国内:王福生团队免疫重建新探索
在艾滋病治疗的艰难探索道路上,王福生院士带领的团队聚焦人脐带间充质干细胞(hUC - MSC)对艾滋病治疗的研究。部分艾滋病患者接受常规治疗后仍存在免疫重建不良问题,被称为免疫无应答者(INR),他们面临更高的机会性感染风险,预期寿命较短,有效治疗这一群体是临床重大挑战之一。

王福生团队基于此背景,致力于探索干细胞能否助力艾滋病患者实现“免疫重建”,期望通过深入研究,为传统治疗中免疫恢复不佳的艾滋病患者找到新的有效治疗手段,改善其病情与生活质量。
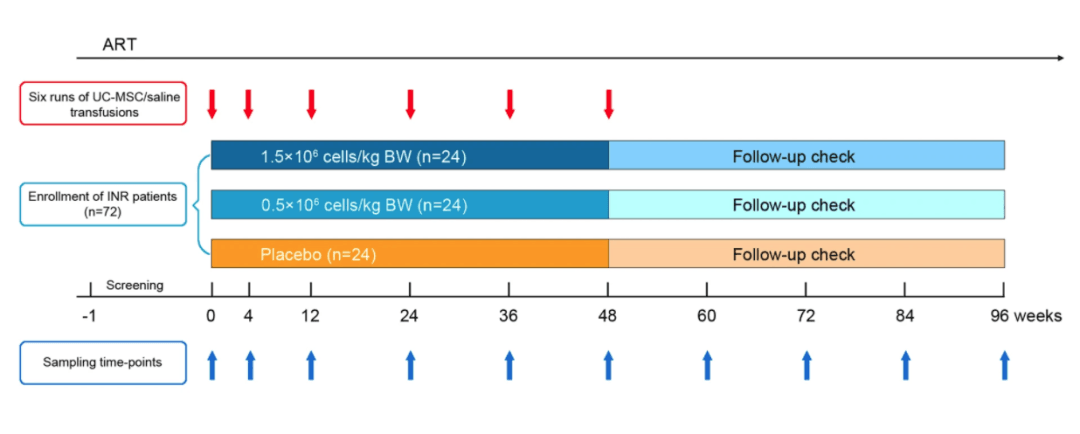
为深入探究干细胞在艾滋病治疗中的作用,团队精心设计并开展了一项针对 HIV - 1 INR 患者的 hUC - MSC 输注多中心、随机、双盲、安慰剂对照、剂量确定的 II 期临床试验。
2013 年 5 月至 2016 年 3 月期间,团队招募 72 名符合条件的 HIV - 1 INR 患者参与试验,将其随机分配至高剂量(1.5 × 10⁶ 细胞 /kg 体重 hUC - MSC 注射,24 名患者)、低剂量(0.5 × 10⁶ 细胞 /kg 体重 hUC - MSC 注射,24 名患者)或对照组(生理盐水,24 名患者)三个组别,并按既定时间安排在第 0、1、3、6、9 和 12 个月接受相应治疗。
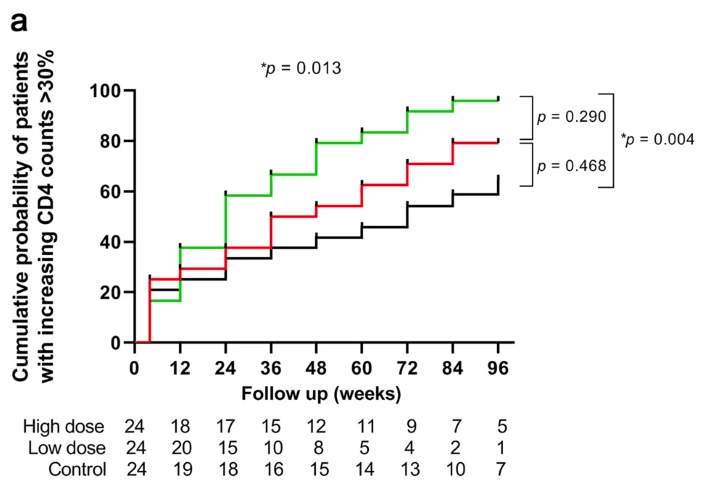
整个试验过程中,研究团队对患者进行长期随访观察,最终 67 名患者完成 96 周随访,低剂量组 5 名患者失访。数据分析显示,与基线相比,治疗 48 周后,高剂量组(P < 0.001)和低剂量组(P < 0.001)的 CD4 + T 细胞数量显著增加,对照组无明显变化。此外,Kaplan - Meier 分析表明,低剂量组获得免疫应答的累积概率高于对照组,分别为 95.8% 和 70.8%(P = 0.004)。但三组患者的 CD4/CD8 + T 计数和 CD4/CD8 比率无显著变化。这些详实数据有力展示了此次临床试验的阶段性研究成果。
总结
王福生院士团队的研究成果意义重大,充分证明间充质干细胞对治疗 HIV - 1 的 INR 患者耐受性良好,且在一定程度上有效改善了患者的宿主免疫重建情况。该成果为免疫重建不良的艾滋病患者提供了一种崭新且极具潜力的治疗手段,与现有联合抗逆转录病毒治疗(ART)相结合,有望进一步提升治疗效果,为患者带来更多健康希望,也为后续艾滋病治疗研究指明了新的方向,激励更多科研人员投身这一领域,共同攻克艾滋病难题。
参考文献
[1]张琪.全球科技要闻[J].环球科学,2024(17):21-21
[2]龚梁,陈智.应用脐血造血干细胞治疗艾滋病的研究进展[J].国外医学.流行病学传染病学分册,2005,(02):77-79.
[3]Xu, M. CCR5-Δ32 biology, gene editing, and warnings for the future of CRISPR-Cas9 as a human and humane gene editing tool. Cell Biosci 10, 48 (2020).
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|Lin.ZG
审核|Geng.ZG

