
随着全球人口老龄化的不断加剧,由糖尿症、代谢性疾病、老年疾病以及肿瘤等引发的慢性难愈性创面问题愈发显著,尤其在失能老人中更为普遍。这些慢性难愈合创面已成为全球公共卫生领域的一大挑战,其愈合过程复杂多变,涉及多个相互交织的空间与时间阶段,对现有的临床治疗方法提出了严峻考验。在这一背景下,外泌体凭借其独特的生物学特性和在创面愈合中的关键作用而备受瞩目。作为细胞间通讯的新型媒介,外泌体广泛分布于多种体液中,展现出低免疫原性、无致瘤风险及卓越的生物相容性等特性,这使得外泌体在慢性难愈合创面的治疗中展现出巨大的潜力。
什么是慢性创面?
慢性创面主要指由多种因素,如糖尿病、压力损伤、动脉/静脉功能不全、缺血性损伤、感染性伤口和手术伤口等引起,持续4~12周仍未愈合或未表现出愈合趋势的创面。目前慢性难愈合创面是全球范围内的主要临床治疗难题,严重的甚至危及生命。
外泌体(Exos)的优势
(1) 生物相容性和稳定性:Exos可以作为介质通过生物屏障,其脂质双层结构可以保护转运物质,实现细胞间的广泛转运,完成多种生物学过程。
(2) 生物活性分子资源丰富:Exos分泌的细胞因子等活性物质可以促进伤口血管化改善伤口循环、调节炎症应激状态和募集干细胞进一步促进伤口修复。
(3) 精准靶向传递:Exos特定的表面蛋白,可以实现载体的靶向转运从而提高治疗的精确性,例如作为药物载体,可以提高药物治疗的有效浓度。
(4) 工程化外泌体:靶向编辑Exos内容、预处理MSCs或人工修饰Exos表面分子受体,可以提升Exos的修复效果。
Exos在皮肤损伤愈合各阶段的作用
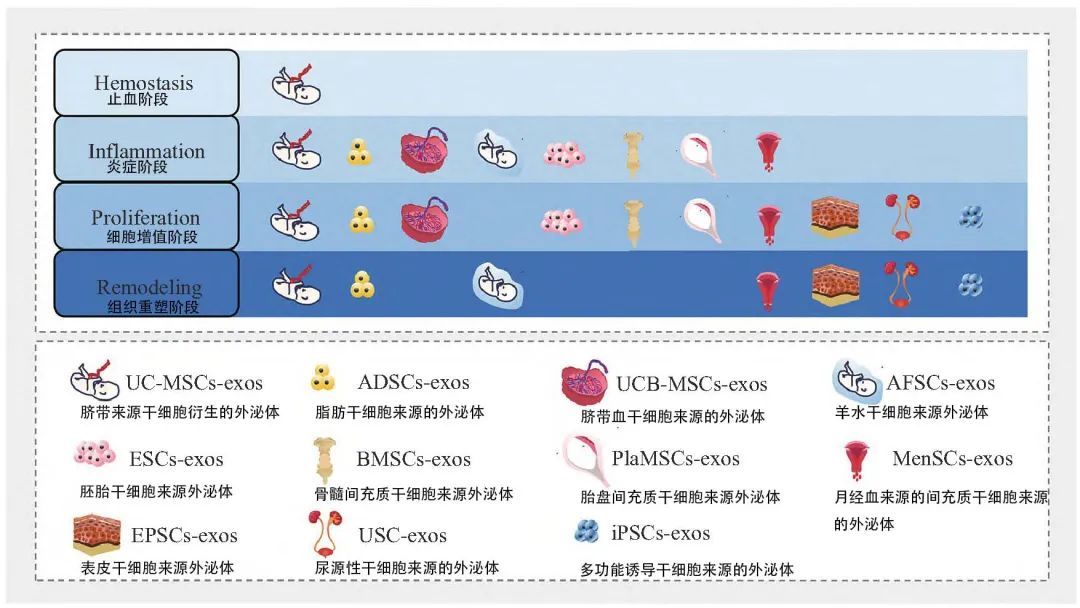
皮肤组织损伤后的伤口愈合是一个复杂且精细的过程,包括止血、炎症、细胞增殖和组织重塑这四个重叠的独立阶段。在这些阶段中,不同来源的外泌体在创面愈合过程各阶段发挥着重要的治疗作用,有助于快速闭合损伤、预防感染和形成功能性瘢痕,从而确保创面愈合的顺利进行。
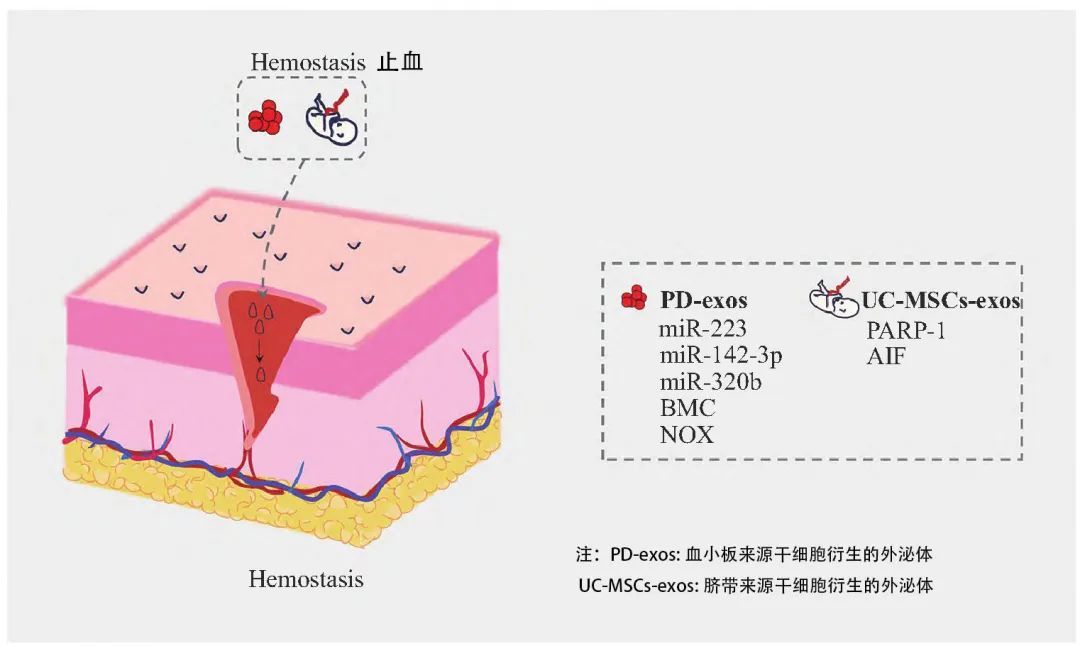
止血期
在止血期,伤口形成后立刻进入止血阶段,此时血小板会聚集到损伤处形成血凝块止血,并为细胞迁移提供了临时的细胞外基质。Exos在此阶段主要通过分泌氧化酶和糖蛋白促进血小板的活化和聚集来加速止血过程。
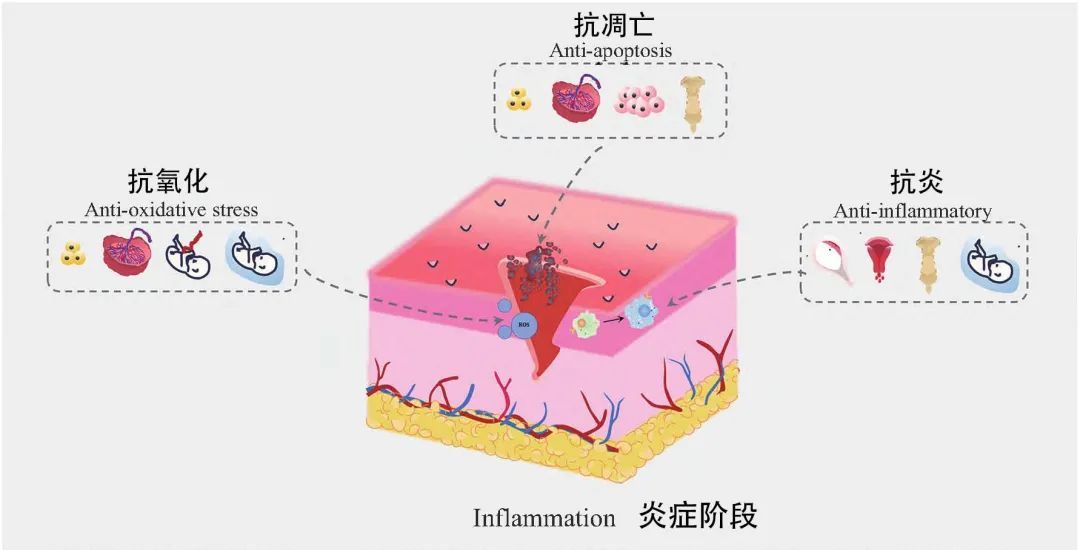
炎症期
胎盘间充质干细胞来源外泌体
(PlaMSCs-exos)
具有显著的抗炎作用,能够调节信号通路如ERK、JNK、p38 MAPK、PI3K、AKT、NF-κB等,抑制炎症反应。同时,能促进创面再生,通过促进血管生成相关基因表达、刺激内皮血管形成、促进细胞迁移等方式,加速组织修复。此外,还能促进自主神经恢复,通过激活MAPKK/ERK/CREB信号转导,为组织修复提供更全面的支持。
脂肪干细胞来源外泌体
(ADSCs-exos)
具有强大的抗氧化能力,能够抑制ROS生成,下调NOX1、NOX4水平,减轻氧化应激损伤。它们还能抑制炎症细胞因子如IL-1β、IL-6和TNF-α的分泌,减轻炎症反应。此外,ADSCs-exos还能促进血管生成,提高VEGF、VEGFR2磷酸化水平,促进内皮祖细胞增殖,为组织修复提供必要的血管支持。预处理如低氧条件下培养的ADSCs-exos具有额外的抗炎、促血管生成作用,并能在高糖环境下促进血管生成,后期还能抑制瘢痕形成,促进真皮细胞和KC(角质形成细胞)增殖。
脐带血干细胞来源外泌体
(UCB-MSCs-exos)
具有显著的抗氧化能力,能够提高细胞抗氧化能力,如通过miR-185-185p/CDK6级联反应降低细胞内ROS水平。它们还能抑制铁凋亡,通过靶基因DMT1降低细胞内ROS水平,保护细胞免受氧化应激损伤。此外,还能促进皮肤再生,刺激HDF中的ECM(细胞外基质)蛋白生长和分泌,为组织修复提供必要的结构支持。
胚胎干细胞来源外泌体
(ESCs-exos)
具有促进血管形成和细胞增殖的作用,能够上调抗炎细胞因子表达,抑制炎症和细胞凋亡。同时,它们还能下调促纤维化标志物表达,通过miR-6766-3p下调TGF-β及其下游SMADs蛋白的表达,减轻纤维化反应,为组织修复提供更良好的微环境。
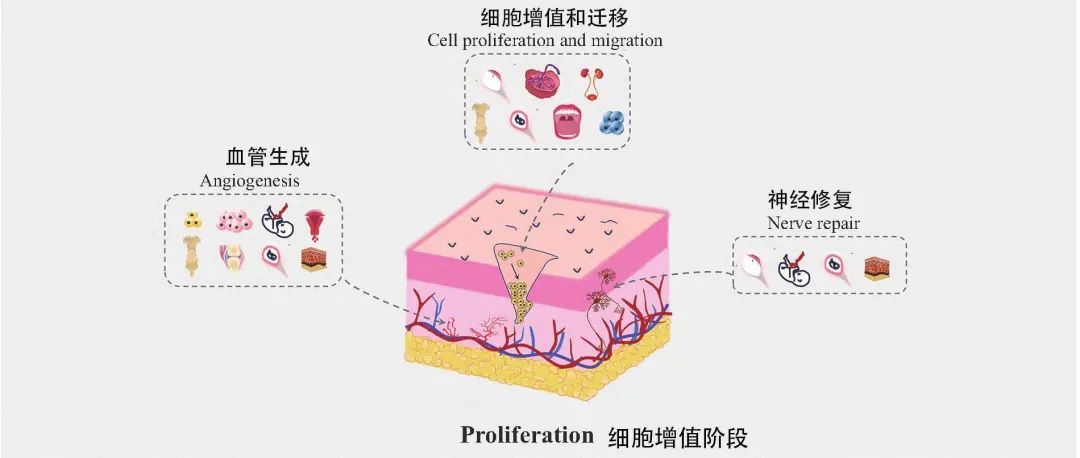
增殖期
增殖期包括细胞增殖与迁移、以及血管生成两个部分。
1.细胞增殖与迁移
脐带间充质干细胞来源外泌体
(UC-MSCs-exos)
上调CD206、CD31、VEGF等愈合标志物,下调TNF-α。促进HUVECs和NIH 3T3细胞增殖,减轻氧化应激损伤,加速伤口愈合。体内减少炎症浸润、加快血管重塑、促进胶原纤维增殖。
尿源性干细胞来源的外泌体
(USCs-exos)
增强KC、HDF、HUVEC等细胞增殖和迁移能力,以及内皮细胞血管生成能力。富含VEGFA、SRPX2、ANGPTL4等促进伤口愈合的蛋白质。促进NPC增殖和ECM合成,激活TGF-β,提高SMAD和AKT磷酸化水平。DMBT1显著诱导VEGFA高表达和AKT磷酸化。
月经血来源的间充质干细胞来源外泌体(MenSCs-exos)
具备无痛、无伦理问题、表达OCT-4(ESCs标志物)的优势。能激活NF-κB诱导巨噬细胞极化抑制炎症。下调I/III型胶原比值减少瘢痕形成。上调collagen I的mRNA促进再上皮化,提高伤口闭合率。上调VEGFA促进新生血管生成。递送调节蛋白和mRNA(let-7、miR21)改善受损细胞和组织再生修复。
2、血管生成
骨髓间充质干细胞来源外泌体
(BMSCs-exos)
首个被研究的干细胞Exos。能调控炎症阶段巨噬细胞表型转变,促进抗炎能力。miR-223靶向PKNOX1调节巨噬细胞极化。表达miR-126的BMSCs-exos促进HUVECs增殖、迁移和血管生成。表达lncRNA KLF3-AS1的BMSCs-exos促进高糖环境下HUVECs增殖、迁移和管腔形成,抑制细胞凋亡,下调miR-383促进VEGFA表达。
滑膜间充质干细胞来源外泌体
(SMSCs-exos)
不具备促血管生成能力,但可通过基因过表达技术修饰,如过表达miR-126-3p,增强血管生成能力。激活PI3K/AKT和MAPK/ERK通路,加速上皮再生和体内胶原成熟。
人羊膜间充质干细胞来源外泌体
(hAM-SCs-exos)
上胚层多能祖细胞,具有胚胎干细胞和间充质干细胞特征。能分泌抗凋亡、抗纤维化、抗炎和促血管生成相关的多种细胞因子。含有与血管生成相关的lncRNA,如PANTR1、H19、OIP5-AS1和NR2F1-AS1,调节内皮细胞迁移、增殖和血管形成。通过Exos诱导的SOX2/FN1通路促进坐骨神经修复,对神经损伤具有治疗作用。
重塑期
表皮干细胞来源外泌体
(EPSCs-exos)
促进全层创面血管生成和表皮层再生。富含特异性miRNA(如miR-425-5p和miR-142-3p),通过下调TGF-β1表达抑制胶原沉积,改善collagen分布,提升再生水平。
角质形成细胞来源外泌体
(Ker-exos)
表达miR-16-5p的Ker-exos减少胶原沉积。抑制TGF-β1对HDF增殖迁移和COL1A1表达的促进作用,具有治疗皮肤增生性瘢痕和纤维化疾病的潜力。
口腔黏膜前体细胞来源外泌体
(OMLP-PCL-exos)
具有多能、免疫抑制和抗菌作用。促进细胞增殖和伤口再生,下调肌成纤维细胞形成。在小鼠创伤模型中抑制αSMA阳性肌纤维母细胞形成,减少胶原沉积。
多功能诱导干细胞来源外泌体
(iPSCs-exos)
含有多种人类iPSCs衍生蛋白和mRNA、miRNA、lncRNA。下调衰老HDF中SA-β-Gal和MMP-1/3表达,提高细胞活力和collagen分泌,促进真皮基质重建。预处理后可调节IL-25和IL-33表达,抑制皮肤炎症,促进伤口愈合。存在分化潜力受供体细胞来源影响等不确定因素。
胎儿真皮间充质干细胞来源外泌体
(FD-MSCs-exos)
通过Notch信号通路激活HDF运动和分泌能力。抑制瘢痕疙瘩成纤维细胞生物活性,促进凋亡,抑制瘢痕增生。
羊水干细胞来源外泌体
(AFSCs-exos)
影响创面细胞生长、免疫调节、凋亡、抗炎、抗氧化、血管生成和瘢痕形成。通过表达miRNA-146a-5p的AFSCs-exos促进ECM重塑和无瘢痕伤口愈合。调节免疫应答相关组分,抑制纤维化发生,改善瘢痕,调节炎症阶段。
总结与展望
在创面治疗中,单个Exos能够针对伤口愈合的特定环节发挥最佳效果,而多个Exos则可在愈合的不同阶段发挥联合作用。这一发现提示我们,未来的研究应根据创面情况,采用多种Exos的联合应用,以制定个性化的最佳治疗方案。
尽管Exos展现出诸多治疗优势,但仍面临诸多挑战。
成分与条件的不确定性:Exos中的非编码RNA、蛋白质、脂质等物质的含量以及最佳应用条件尚未明确。
成本与来源问题:Exos的来源细胞数量、质量以及成本问题仍需解决,以确保其能够取代或辅助现有的治疗手段。
外部因素的干扰:在Exos作用过程中,如何避免外部因素对其结构、功能及治疗效果的影响,是一个亟待解决的问题。此外,供体自身的健康状况、遗传、性别和年龄等因素也可能影响Exos的治疗效果。
安全性评估:针对Exos的实验开发策略需进一步完善,包括局部、全身、注射等各方面的测试实验,以确定其剂量依赖性。同时,需要更多不同来源的Exos的短期和长期安全性评估,以确保其在临床使用的安全性。
标准化流程的建立:从临床前研究到临床研究的转化过程中,Exos的制备、提取、分离以及长期储存等问题缺乏统一标准。此外,不同Exos具有异质性,其提取和鉴定也需要针对性的策略标准。
因此,为了开发安全、有效、高效率、易生产的Exos及相关产品,我们需要更多的研究来确定不同创面所适用的最佳Exos类型。最终目标是建立起从Exos来源的干细胞到临床治疗的标准化流程,实现Exos在临床促进创面愈合的广阔应用前景。这将为慢性难愈合创面的治疗带来新的突破和希望。
参考文献
【1】滕泳翔,宿刚,李兆欣,等. 不同来源外泌体在创面愈合过程各阶段的治疗作用 [J]. 中国细胞生物学学报, 2024, 46 (09): 1680-1693.
【2】NIU S H, LI B, GU H C, et al. Knowledge mapping of extracellular vesicles in wound healing:a bibliometric analysis(2002-2022)[J]. Int Wound J, 2023, 20(8):3221-40.
【3】 ZHANG Y, SHI L, LI X, et al. Placental stem cells-derived exosomes stimulate cutaneous wound regeneration via engrailed-1inhibition[J]. Front Bioeng Biotechnol, 2022, 10:1044773.
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|Ning.ZG
审核|Geng.ZG

